Guardar energía con estructuras muy pequeñas
José Ramón Herrera* y Marina E. Rincón**
Instituto de Energías Renovables-UNAM
*Estudiante de Doctorado del IER-UNAM. José Ramón Herrera, estudiante de doctorado del Instituto de Energías Renovables en el Posgrado de Ingeniería (Energía) de la UNAM, se interesa por materiales de grafeno y su aplicación en dispositivos de almacenamiento electroquímico de energía.
** Investigadora del IER-UNAM. Miembro de la Academia de Ciencias de Morelos
La electricidad la emplean todos los seres vivos de nuestro planeta. Usted, apreciable lector, interpreta las letras de este texto gracias a las señales eléctricas de las neuronas de su cerebro. Se trata del flujo de unas minúsculas y pequeñas partículas casi sin masa, y con carga eléctrica, llamadas electrones.
A través de años de experimentación, pruebas de ensayo y error y mucha creatividad, la humanidad ha logrado aprovechar el movimiento de estas pequeñas partículas para mejorar nuestra calidad de vida. Desde las lámparas, los refrigeradores, hasta las computadoras y, por supuesto, los teléfonos “inteligentes” y el internet. Todo ello gracias a la comprensión y el dominio de la electricidad. Pero sería imposible utilizar estos dispositivos si no pudiéramos llevar una cierta cantidad de energía en nuestro bolsillo. Y es ahí donde entra el almacenamiento de energía.
Inicio y tipos de baterías
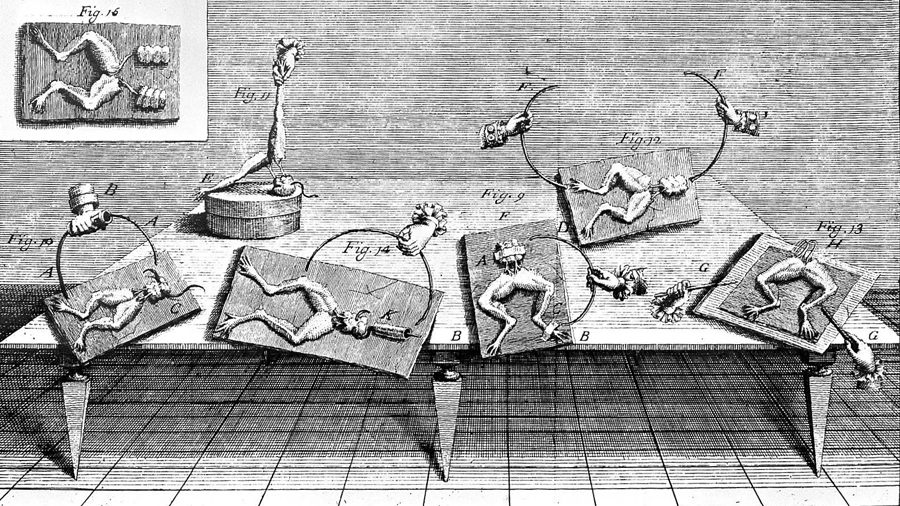
La primera batería (o almacenador de energía) de la que se tiene registro se descubrió por accidente. El científico italiano Luigi Galvani realizaba la disección de una rana que colgaba de un gancho de bronce, y cuando un objeto de hierro tocó accidentalmente los músculos de la rana, éstos se contrajeron. Es decir, la energía almacenada en el circuito creado entre los metales y el músculo de la rana hizo que éste se moviera (véase Figura 1).
Es justamente esta propiedad lo que se aprovecha en una batería. En el caso de la rudimentaria batería de Galvani, los electrones en el bronce pasaban al hierro a través de los nervios y músculos de la rana, generando una corriente eléctrica que provocaba contracciones musculares en la antes inanimada rana. Ahora, la electricidad puede devolver la vida a una persona en estado de shock y en el pasado creó al famoso Frankenstein de la novela de la escritora inglesa Mary Shelley.
Las baterías, también conocidas como pilas, se clasifican en primarias y secundarias. Las primarias no son recargables y transforman la energía química en energía eléctrica, de manera irreversible. Es decir, cuando se agota la cantidad inicial de reactivos presentes en la pila, se acaba la energía y la pila se desecha. Los ejemplos más comunes son la pila alcalina no recargable utilizada para linternas y una multitud de dispositivos portátiles.
Las baterías secundarias se pueden descargar y recargar varias veces; es decir, son recargables. Los ejemplos incluyen las baterías de ácido-plomo usadas en los vehículos, las baterías de ion de litio utilizadas en dispositivos electrónicos portátiles, como celulares, tabletas y computadoras y las baterías recargables de Ni-HM, utilizadas como alternativa o reemplazo de las pilas alcalinas no recargables en cámaras fotográficas digitales, juguetes, radios portátiles, radiograbadoras, linternas, reproductores de mp3 y minidisc, entre otros.
Una batería es un dispositivo capaz de proveer energía eléctrica a través de reacciones químicas que se llevan a cabo en su interior. Consta básicamente de tres componentes (véase figura 2), dos de los cuales son las terminales positiva y negativa de la batería (electrodos) y el tercero es el material que transporta los iones (el electrolito).
Para los electrones un electrolito es una enorme barrera. Necesitan de un vehículo para poder transportarse a través de esa sustancia. Es ahí donde intervienen los iones; moléculas que portan al menos un electrón extra o uno de menos como se indica en la figura 3.
Si imaginamos que las moléculas que forman los iones en un electrolito son pequeños carruajes para nuestros electrones; en una batería no recargable, los electrones logran llegar de un electrodo al otro a través del electrolito, y luego son conducidos por los electrodos y por un “circuito externo” para hacer funcionar nuestro equipo. Pero al llegar a su destino los carruajes quedan estancados y ya no pueden volver a su posición inicial; es decir, al electrodo del que partieron.
En contraste, en una batería recargable, el electrodo puede verse como un estacionamiento especial para carruajes. Al recargar nuestra batería, los minúsculos pasajeros suben a su carruaje, vuelven al punto de partida y quedan listos para otra travesía. Y, por supuesto, hay que recomendar el uso de baterías recargables, que son más amigables con el ambiente.
¿Cómo aumentar la energía almacenada en las baterías?
Actualmente, las baterías de ion de litio son de las que ofrecen más ventajas. Sin embargo, presentan el problema de que los iones tienden a destruir esos pequeños “estacionamientos” o a quedarse estancados. Por ello, se investigan estructuras que puedan funcionar mejor, es decir, proporcionar más espacio y además que dicho espacio tenga la capacidad de transportar los electrones hacia el circuito externo. No es sencillo fabricar estructuras con la forma y propiedades precisas. Los pequeños huecos que se utilizan en las actuales baterías son de alrededor de diez nanómetros (10×10-9 m) y los pequeños iones de litio miden apenas unas centésimas de ese tamaño (aproximadamente de 0.2 nanómetros (nm)).
Como no existen máquinas que reproduzcan de manera confiable dichos espacios es necesario aprovechar materiales que de manera natural los proporcionen y posean las propiedades correctas. Y este es el caso de las llamadas nanoestructruras cristalinas.
Una apuesta interesante está en los materiales compuestos de carbono. El carbono es un material que puede organizarse en diversas estructuras; las más familiares son las del grafito de los lápices, la del diamante de las joyas y el carbono amorfo que usualmente quemamos como combustible en la parrilla de los domingos. En fechas recientes han aparecido otras formas nanométricas del carbono (nuevos alótropos) como las representadas en la figura 4, que han llamado la atención de diversos grupos nacionales e internacionales por sus propiedades y potencial de aplicación, convirtiéndose en el blanco de la investigación teórico-experimental (véase, por ejemplo, los grupos de nanocarbono de universidades como: The Pennsylvania State University, Shinshu University, Universidad de Alicante, UNAM, CINVESTAV, University of Kentucky).
Los carbonos nanométricos derivados de los nanotubos de carbono y el grafito han demostrado proporcionar una excelente superficie para almacenar iones de litio de manera reversible. El grafeno, un material con sólo un átomo de espesor (esto es, una lámina exfoliada del grafito), se sintetizó por vez primera en el año 2004 y su descubrimiento hizo que le otorgaran el premio Nobel a los científicos rusos Andre Geim y Konstantin Novoselov en 2010. El grafeno posee propiedades excepcionales como tener mayor resistencia mecánica que el acero y una excelente conductividad térmica y eléctrica [3]. Han transcurrido ocho años desde la entrega del premio Nobel y todavía no existen todos los dispositivos que se pronosticaron para esta época, aunque el desarrollo orientado a las nanoestructuras derivadas del grafeno continúa, particularmente aquellas relacionadas con materiales para electrodos en almacenamiento de energía.
En el Laboratorio de Óxidos Metálicos y Nanocarbono, del Instituto de Energías Renovables (IER-UNAM), hemos aportado mucho al conocimiento de las nanoestructuras basadas en nanotubos de carbono, óxido de grafeno y nanotiras de grafeno. Las hemos utilizado como componentes de varios dispositivos portátiles [4], y estamos por abordar el almacenamiento de energía a gran escala, es decir, aquel que se emplea para guardar la energía del Sol, el viento y las olas, tres de las principales fuentes renovables de energía.
Para pequeños o grandes dispositivos lo que se quiere es que nuestras pilas duren mucho tiempo cargadas y que cuando queramos aprovechar dicha energía se entregue rápidamente. Las propiedades nanométricas del carbono, sin duda tendrán mucho que ver con estos desarrollos.
Hacia dónde vamos
En México, hace 33 años, en 1985, los teléfonos celulares eran una novedad [5] y dependían de estar conectados a la batería de un automóvil para funcionar. Sin embargo, con el surgimiento de las primeras baterías recargables (níquel-cadmio y níquel hidruro metálico) aparecieron los primeros teléfonos celulares que eran realmente portátiles. Al mismo tiempo se desarrollaba la red de internet y toda una nueva generación de baterías mucho más poderosas y estables hicieron su aparición, entre ellas las baterías de ion de litio. El dominio de la energía eléctrica ha modificado sin duda nuestro estilo de vida. Pocos quieren renunciar a la comodidad e independencia de portar una cierta cantidad de energía en el bolsillo; al contrario, cada vez demandamos más funciones y capacidades en estos dispositivos, lo que inevitablemente implica la optimización continua de las baterías y de los materiales de los que están hechos los electrodos; es decir, los “estacionamientos de los carruajes”.
En una entrevista reciente Dieter Zetche, CEO de Daimler Benz (Mercedes Benz), dijo que Tesla era su mayor competidor, además de Google, Apple y Amazon. El enfoque de Tesla no es construir un coche mejor, sino una computadora sobre ruedas que funcione con electricidad, no con gasolina. El CEO pronostica que entre 5 y 10 años la fuente de esta energía limpia y barata será la solar. Es más, conforme el software irrumpe en la mayoría de las industrias tradicionales (sólo vean el progreso de Uber, Airbnb, IBM Watson), el celular se vuelve imprescindible. Sin duda alguna tendrá más y más capacidades y requerirá de mejores baterías. Soñemos con aplicaciones y dispositivos cada vez más ambiciosos e inexistentes, sin olvidar que todos ellos requieren de energía. Institutos como el IER-UNAM se vuelven cada vez más relevantes y le apuesta a aquellos comprometidos con las energías limpias.
Referencias
- https://es.wikipedia.org/wiki/Luigi_Galvani
- https://es.wikipedia.org/wiki/Nanotubo#/media/File:Eight_Allotropes_of_Carbon.png
- http://www.acmor.org.mx/grafeno-viejo-conocido-y-éxito-actual-en-la-nanotecnología
- http://www.ier.unam.mx/academicos/merg/
- https://es.wikipedia.org/wiki/Telefonía_móvil_en_México
Fuente: Academia de Ciencias de Morelos