Una revolución electrizante
Juan Fernando Méndez Vázquez* y Fabián Fernández-Luqueño**
*Estudiante de Maestría en Ciencias en Sustentabilidad de los Recursos Naturales y Energía, Cinvestav Saltillo
**Coordinador Académico de los Programas de Maestría y Doctorado en Ciencias en Sustentabilidad de los Recursos Naturales y Energía, Cinvestav Saltillo
Actualmente los niveles de contaminación son considerados en la toma de decisiones solo en algunas ocasiones. Difícilmente se acepta que la explotación de los recursos naturales haya causado el deterioro de los ecosistemas, los cuales son nuestra riqueza, responsabilidad y herencia generacional. Por fortuna, con el el tiempo se han logrado avances tecnológicos significativos mediante la experimentación o el modelado matemático para generar conocimiento que enmiende nuestros errores y disminuya la degradación de los ecosistemas.
Uno de estos avances tecnológicos es la Electroquímica (EQ), encargada de estudiar la transformación y aprovechamiento de la energía mediante reacciones químicas y sus diversas aplicaciones en la vida diaria. Algunas de estas aplicaciones son el almacenamiento de la electricidad y la remediación de sitios contaminados por diversas fuentes, las cuales han alterado el equilibrio del suelo, sus microorganismos y su vegetación.
Los sistemas electroquímicos (SEQ) son aquellos en los que se puede obtener y almacenar energía mediante reacciones químicas. La generación de energía se realiza a través de celdas voltaicas y galvánicas que generan un flujo de electrones mediante reacciones espontáneas de reducción y oxidación. El almacenamiento de energía se realiza en baterías, las cuales son conocidas como generadores secundarios debido a que para funcionar se les debe suministrar electricidad mediante un proceso de carga [1].
Los SEQ constan de cuatro componentes indispensables, los cuales se muestran en la Figura 1:
- Batería: presente en las celdas voltaicas para provocar las reacciones redox (Fig. 1a).
- Electrodos: comúnmente son barras metálicas en las cuales se llevan al cabo las reacciones redox (oxidación y reducción), cambiando los estados de valencia. Son conocidos como: cátodo (-; Fig. 1b) y ánodo (+; Fig. 1c).
- Electrolito: es una sustancia líquida que contiene sales disueltas (Fig. 1d) y favorece la formación de iones (Fig. 1e).
- Puente externo: transporta los electrones a través de una conexión externa la cual cierra el circuito (Fig. 1f).
Como se indica en la Fig. 1, la energía de la batería pasa hacia los electrodos y se llevan al cabo las reacciones redox dentro del electrolito (la reducción en el cátodo y la oxidación en el ánodo), separando al electrolito en iones que serán atraídos por las cargas de los electrodos y podemos obtener diversos compuestos gaseosos (e.g. hidrógeno y oxígeno de la hidrólisis del agua).
Por otro lado, si buscamos almacenar la energía producida por la reacción entre el electrolito y los electrodos necesitaremos que el electrolito sea compatible con un electrodo para que se dé el flujo de iones y los electrones equilibren la reacción. Podemos aprovechar este flujo de electrones para almacenar la energía o usarla de forma directa.
La EQ basa su funcionamiento en las Leyes sobre electrólisis de Faraday, las cuales indican que la cantidad de material que será depositada de un electrodo a otro está relacionada con la corriente (flujo de electrones) y la masa atómica de los elementos. Estas dependen también de la concentración, presión y temperatura a las que operan los SEQ.
Como todo, los SEQ no son perfectos, pues deben ser alimentados con electricidad, que es generada por fuentes de combustible tradicionales, las cuales tienen una eficiencia cercana al 40 % y emiten gases de efecto invernadero. Los SEQ juegan un papel fundamental en la transición energética de las fuentes convencionales de energía hacia el uso de las energías renovables debido a las intermitencias presentes en estas últimas (e.g. los sistemas fotovoltaicos requieren baterías para proveer electricidad durante la noche o los días muy nublados).
Es importante recordar que existen dos tipos de celdas: la galvánica y la voltaica. En la primera ocurren reacciones espontáneas de las que se puede obtener una corriente eléctrica debido a la diferencia de potenciales (voltaje) entre los electrodos. En las celdas voltaicas es necesario proveer energía eléctrica para que se den las reacciones redox.
La EQ se emplea a gran escala en la industria debido a sus aplicaciones tan diversas como la galvanoplastia (recubrimiento de metales para evitar corrosión), la electrólisis del agua (descomposición de la molécula del H2O en los gases hidrógeno [H2] y oxígeno [O2] en una celda voltaica), así como la obtención de diversos componentes gaseosos como el cloro.
Por otro lado, los principios electroquímicos (atracción de los iones positivos o negativos a los electrodos respectivos) se han empleado en la gestión ambiental a través de la electrocoagulación de tintas, la desalinización del agua para el consumo humano, entre otros.
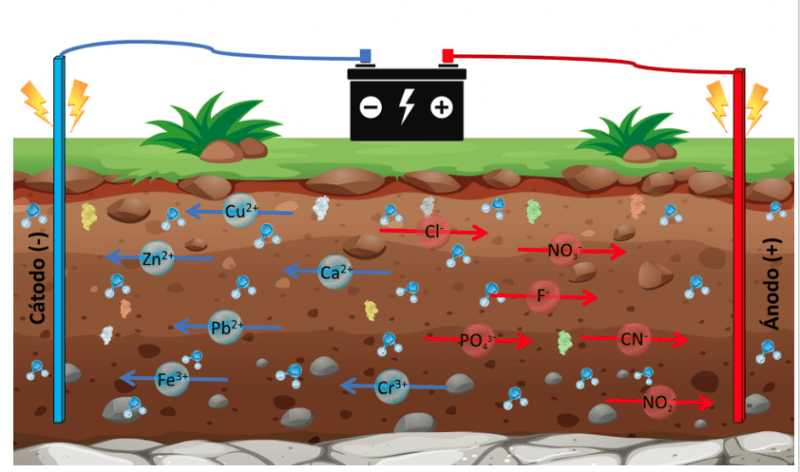
Por último, pero no menos importante, se encuentra la aplicación electrocinética para la remediación de los suelos (Figura 2), la cual consiste en suministrar una corriente directa a los electrodos distribuidos en la superficie del suelo, adicionando agua o algún electrolito como hidróxido de sodio (NaOH) para optimizar el transporte de los contaminantes a los electrodos y facilitar el contacto entre estos.
La diferencia de voltaje entre los electrodos da paso a la electrólisis del agua, produciendo iones gaseosos Hidrógeno (H+) e Hidroxilos (OH–); el H+ migra al ánodo a través del suelo y los OH– al cátodo.
Dependiendo de esta migración, muchos procesos fisicoquímicos que son controlados por el pH se verán afectados. Entre ellos están la absorción, desorción, disolución, precipitación, oxidación y reducción de los contaminantes. Para evitar la modificación del pH del suelo cercano al electrodo se recomienda cambiar la polaridad de los electrodos, ya que estos acidifican o alcalinizan el suelo cercano a ellos. Además, es de vital importancia conocer las características fisicoquímicas del suelo ya que la capacidad de intercambio catiónica, la permeabilidad y la conductividad eléctrica afectarán el desempeño de la electrocinética.
La selección de los electrodos para la electrorremediación se basa en la naturaleza de los contaminantes, pues los metales pesados han sido removidos con gran eficacia al usar electrodos de titanio. Además, los electrodos deben ser inertes para evitar la incorporación de nuevos contaminantes por el desgaste de estos.
El campo eléctrico de los electrodos conduce los contaminantes hacia ellos a través de los siguientes mecanismos: electroósmosis, electromigración y eletroforesis. La electroósmosis es el desplazamiento del líquido inducido por el campo eléctrico, con respecto a la superficie sólida. La electromigración es el movimiento de especies iónicas disueltas y la electroforesis es el desplazamiento de partículas coloidales en suspensión. Generalmente, durante la electrorremediación, los tres mecanismos descritos previamente se desarrollan al mismo tiempo.
Los SEQ para la remediación electrocinética son seguros porque se suministran corrientes del orden de 1 a 3 volts por cm. y se emplean electrolitos no tóxicos [2]. Además, se pueden tratar diversos contaminantes, orgánicos o inorgánicos, en distintas fases (sólido, liquido o gaseoso). Igualmente, la electrorremediación de suelos se ha empleado junto con otras técnicas como la fitorremediación (remediación de suelos mediante el uso de plantas), observando que la aplicación de electricidad ayuda a la degradación y fitoestabilización de los contaminantes. Sin embargo, es necesario realizar estudios sobre la acción de la electricidad en el crecimiento de las plantas y los efectos en los meso y microorganismos del suelo.

La remediación electrocinética o electrorremediación puede usarse para:
- Remoción de iones metálicos por electromigración.
- Remoción de especies volátiles y semivolátiles al incrementar la temperatura.
- Remoción de especies aniónicas con la adición de surfactantes. Este proceso es conocido como EKSF por sus siglas en inglés (electrokinetic soil flushing).
- Reducción en la concentración de metales pesados en lodos.
- Remediación de suelos contaminados por pesticidas.
Como se ha indicado, la EQ puede adaptarse para diversos procesos en la industria química, metalúrgica, energética y ambiental. Por consiguiente, la EQ es un área del conocimiento que seguirá brindando beneficios a la sociedad a través de la generación y almacenamiento de energía, la limpieza de sitios contaminados, la síntesis de nuevos materiales y el aprovechamiento de recursos minerales, entre otros.
Juan Fernando Méndez Vázquez y Fabían Fernández Luqueño, del Cinvestav Unidad Saltillo
Bibliografía
[1] S. Bebelis K. Bouzek A. Cornell M.G.S. Ferreira G.H. Kelsall F. Lapicque C. Ponce de Le´on M.A. Rodrigo F.C. (2013), Hihlights during the development of Electrochemical Engineering, Chemical Engineering Research and Design, 1362, 1-74.
[2] V. Sánchez, F. López-Bellido, P. Cañizares, L. Rodríguez. (2018), Can electrochemistry enhance the removal of organic pollutants by phytoremediation?, Journal of Environmental Management, 225, 280-287.
Fuente: Revista Avance y Perspectiva




