Premio Nobel 2020 a la tijera molecular: CRISPR/Cas9
Jorge Aragón, Rosa María Bermúdez* y Cecilia Montañez***
*Departamento de Genética y Biología Molecular, Cinvestav
**Auxiliar de Investigación en el Departamento de Genética y Biología Molecular del CINVESTAV-IPN. SNI Nivel I.
***Investigadora del Departamento de Genética y Biología Molecular del Cinvestav . Miembro del Sistema Nacional de Investigadores Nivel III.
Los descubrimientos que mostraron que la herencia de las características de los progenitores se transmite a los descendientes a través de los genes, trajeron consigo la necesidad de estudiar su función en el genoma de los seres vivos. Los genes, que dirigen la síntesis de las proteínas, consisten en secuencias específicas de las unidades que los componen (nucleótidos), localizados dentro del genoma de cada una de las especies. A través de la historia de la Genética y Biología Molecular, se han desarrollado diferentes métodos para estudiar el papel que desempeñan las proteínas. Dentro de estos métodos, se encuentra la modificación de la secuencia de los genes o regiones de control responsables de su expresión. Estas modificaciones, que corresponden en muchos casos a mutaciones, han permitido reprimir o activar la expresión de los genes utilizando metodologías que consumían mucho tiempo, recursos materiales y económicos. En 2012, Jinek y colaboradores, dirigidos por las científicas Jennifer Anne Doudna y Emmanuelle Charpentier, describieron un método sencillo, rápido y eficaz para modificar la información genética utilizando la herramienta CRISPR/Cas9 (por sus siglas en inglés: “Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated [Cas] protein 9”; en español: Repeticiones palindrómicas cortas agrupadas regularmente interespaciadas/Proteína 9 asociada a CRISPR [Cas]). Este mecanismo lo presentan de manera natural las bacterias para defenderse de la introducción del material genético exógeno, como es el caso de la infección por bacteriófagos y plásmidos, entre otros.
Las galardonadas por el Nobel de Química 2020
Jennifer Anne Doudna es una bioquímica estadounidense nacida en 1964 en Washington, Estados Unidos. Estudió la licenciatura en Química en la Universidad de Pomona, el doctorado en Bioquímica en la Universidad de Harvard y realizó una estancia postdoctoral en la Universidad de Colorado. Actualmente es profesora en los Departamentos de Química y Biología Molecular y Celular de la Universidad de California, Berkeley, Estados Unidos, así como investigadora del Instituto Médico Howard Hughes. La Dra. Doudna ha recibido numerosos premios por sus descubrimientos, entre ellos el Premio Japón (2016), el Premio Kavli (2018), el Premio LUI Che Woo Welfare Betterment (2019), el Premio Wolf en Medicina (2020) y recientemente el Premio Nobel de Química 2020. Además, es líder en la discusión pública de las implicaciones éticas de la edición de los genomas, incluido el humano (https://doudnalab.org/bio/).
Emmanuelle Charpentier es microbióloga, genetista y bioquímica nacida en 1968 en Juvisy-sur-Orge, Francia. Estudió la licenciatura en la Universidad Pierre y Marie Curie, París, Francia y obtuvo el Doctorado en Microbiología en el Instituto Pasteur, París, Francia. La Dra. Charpentier desarrolló su carrera científica en instituciones de investigación en Francia, Estados Unidos, Austria, Suecia y actualmente en Alemania. Es fundadora, científica y directora general de la Unidad Max Planck para la ciencia de los patógenos y profesora honoraria en la Universidad Humboldt en Berlín, Alemania. Emmanuelle Charpentier es ampliamente reconocida por las investigaciones que sentaron las bases para desarrollar la tecnología innovadora de ingeniería del genoma mediada por CRISPR/Cas9. Ha recibido numerosos premios y distinciones internacionales de prestigio, incluido el Premio Nobel de Química 2020 y es miembro de sociedades científicas nacionales e internacionales. Es cofundadora de CRISPR Therapeutics y ERS Genomics para el desarrollo de la tecnología de ingeniería del genoma CRISPR/Cas en aplicaciones biotecnológicas y biomédicas (https://www.emmanuelle-charpentier-pr.org/short-biography/).
El desarrollo de la tecnología de ingeniería genética CRISPR/Cas9, por ambas investigadoras, cambió de manera definitiva la investigación en genómica, debido a que permite la edición de los genomas modificando o eliminando rápidamente y con gran precisión genes o grupos de genes. La edición significa corregir, eliminar o añadir características en un organismo, dando lugar a enormes aplicaciones en la biología, la medicina y la agricultura, cambiando drásticamente las perspectivas sobre la modificación de los genomas. La descripción y adaptación del sistema CRISPR/Cas9 como herramienta molecular para modificar los genes de cualquier ser vivo en el laboratorio, les permitió a sus autoras ser galardonadas con el Premio Nobel de Química 2020, anunciado el pasado 7 de octubre en Estocolmo, Suecia.
El método CRISPR/Cas9 para la edición de genes
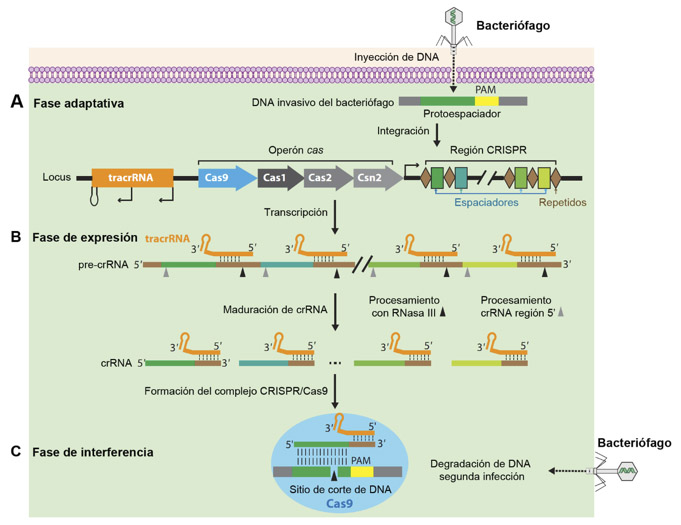
Actualmente se sabe que los sistemas CRISPR/Cas están presentes de manera natural en un gran número de bacterias, en casi todas las arqueas (antes arqueobacterias), en algunos bacteriófagos y plásmidos (fragmentos de DNA [ácido desoxirribonucleico] no unido al cromosoma), (Kamruzzaman e Iredell, 2020). El sistema CRISPR/Cas proporciona a las bacterias inmunidad adaptativa en un proceso en donde éstas capturan fragmentos de DNA provenientes de bacteriófagos o plásmidos y los incorporan a su genoma dentro de la región CRISPR (Figura 1A). Este mecanismo proporciona a las bacterias el registro genético de una primera infección que les permitirá prevenir que ocurra por segunda ocasión (Jiang y Doudna 2015, 2017). Aunque el sistema CRISPR/Cas tomó auge a partir del 2012, cuando se describió como una herramienta de laboratorio para modificar los genes, existen trabajos desde los años 80 donde se describe este mecanismo que incluye un RNA (ácido ribonucleico) que identifica e interacciona con el DNA o RNA blanco y una proteína Cas que puede cortar de manera precisa tanto DNA como RNA.
Con base en la organización del operón que contiene la región CRISPR y a los genes para las proteínas Cas, este sistema se clasifica en tres tipos principales (I, II y III), que a su vez se dividen en 11 subtipos (IA a IF, II-A a II-C y III-A a III-B) (Jiang y Doudna 2015); algunos de estos procesan DNA y otros, RNA. El sistema CRISPR/Cas9 forma parte del tipo II, que se ha identificado exclusivamente en bacterias y utiliza una sola proteína nucleasa multifuncional (Cas9) para el reconocimiento y corte del DNA. Dentro del genoma de las bacterias, el operón CRISPR/Cas9 contiene una familia de trans-activadores de RNA de CRISPR (tracrRNA) que se requiere para la maduración del RNA de CRISPR (crRNA), seguido de otros genes cas (cas9, cas1, cas2 y csn2), que promueven la incorporación de material genético foráneo al genoma bacteriano y la región CRISPR que contiene las secuencias incorporadas (protoespaciador) de los bacteriófagos o plásmidos invasores, separadas por secuencias repetidas (Figura 1A) (Jiang y Doudna 2017).
La inmunidad mediada por CRISPR/Cas9 se produce en tres etapas principales: 1) en la fase adaptativa, las bacterias responden al virus mediante la integración de fragmentos cortos de DNA viral en su genoma dentro de la región CRISPR (Figura 1A); 2) en la fase de expresión, por un lado, la transcripción de los elementos espaciadores-repetidos genera un RNA precursor de CRISPR (pre-crRNA) y, por otro lado, se transcriben los RNA trans-activadores (tracrRNA). Este último RNA contiene una secuencia que activa a la nucleasa de Cas9 y una región que se aparea con los repetidos dentro del pre-crRNA, permitiéndose la maduración del RNA de CRISPR (crRNA) mediante un procesamiento enzimático con la RNasa III (enzima de la bacteria hospedera). El crRNA maduro contiene la secuencia del virus integrado previamente y una parte de los repetidos en donde interacciona el tracrRNA formando un complejo RNA-RNA (Figure 1B); y 3) en la fase de interferencia participan dos componentes principales: a) un RNA, de la infección viral previa, que sirve de guía para identificar e interaccionar con el DNA de la nueva infección, y b) la proteína Cas9, una enzima endonucleasa que corta el DNA para evitar una segunda infección (Figura 1C) (Jiang y Doudna 2017). Gracias a la sencillez del sistema tipo II (nucleasa Cas9 y RNA guía) para dirigirse al blanco deseado, Doudna, Charpentier y colaboradores, implementaron este sistema para editar DNA que al ser cortado puede ser reparado por la maquinaria reparación de DNA de la célula. Las vías de reparación pueden requerir un DNA que sirva como molde para incorporar los cambios, o en ausencia de un molde se repara de manera general el DNA eliminando, insertando algunos nucleótidos (Figura 2A) o cambiando un solo nucleótido (Figura 2B).
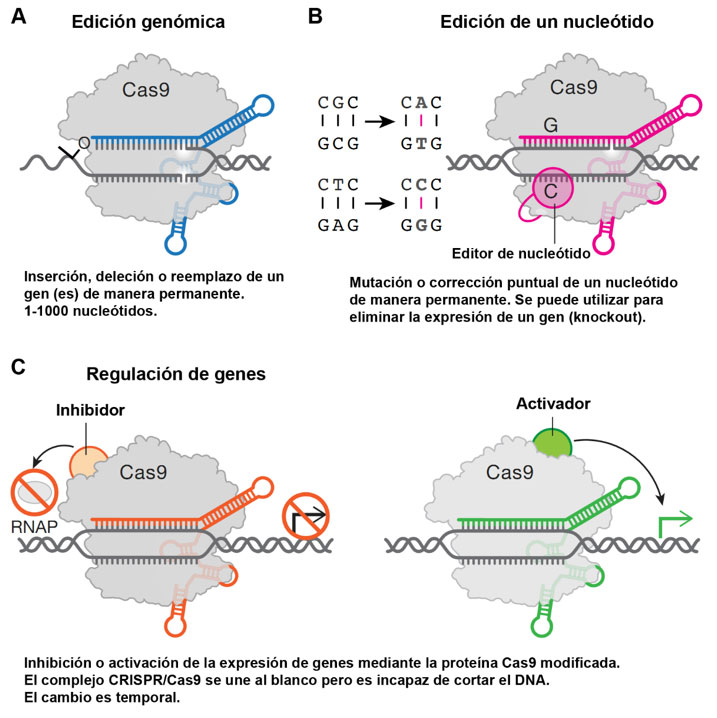
En 2012, Jinek y colaboradores, bajo la dirección de las Dras. Doudna y Charpentier, describieron y adaptaron el sistema CRISPR/Cas9 de la bacteria Streptococcus pyogenes para utilizarlo como una herramienta de laboratorio para la escisión de DNA en sitios específicos y destacaron el potencial del sistema para la edición del genoma utilizando un RNA guía (fusión de crRNA y tracrRNA) que se podía programar para cualquier secuencia de DNA (Jinek et al., 2012). Este sistema CRISPR/Cas9 es una tecnología que hace posible corregir errores en el genoma y activar o inhibir genes en células y organismos de manera más fácil y precisa que los métodos descritos antes de este descubrimiento. Permite reconocer un sitio específico en los organismos donde se introduce una secuencia y allí cortar las hebras del DNA; de esa forma se pueden silenciar genes o introducir nuevo material genético (Doudna y Charpentier 2014). Este método funciona como unas “tijeras moleculares” que se pueden programar para realizar una cirugía precisa en los genes de interés (Charpentier 2015).
La versatilidad de esta metodología ha permitido implementar el uso de la nucleasa modificada iCas9 (catalíticamente inactiva, CRISPR/iCas9) para silenciar genes. La enzima iCas9 se puede unir a la región blanco (generalmente el inicio de los genes) y al ser incapaz de realizar un corte, permanece unida a este sitio e inhibe la expresión del gen de interés, impidiendo el reclutamiento de factores necesarios para la expresión; asimismo, se ha implementado el uso de un sistema activador (CRISPR/aCas9) el cual favorece la unión de los factores de trascripción incrementando la expresión de los genes (Figura 2C). De igual manera, se ha puesto en funcionamiento el uso de Cas9 fusionada a etiquetas convencionales, que se puede detectar usando anticuerpos contra las etiquetas, para determinar la localización subcelular de proteínas que se unen a alguna secuencia de DNA particular.
Aplicaciones de CRISPR/Cas: beneficios y riesgos
El impacto de esta tecnología en el desarrollo de la ciencia básica, la medicina y la agricultura ha sido enorme en el mundo. Se ha utilizado para el tratamiento de enfermedades en modelos animales y se han modificado las características genéticas de un gran número de organismos entre los que se encuentran bacterias, levaduras, plantas, mamíferos, etcétera. Desde su descripción en 2012, se ha adoptado esta metodología por muchos laboratorios de investigación en el desarrollo de tratamientos para enfermedades como cáncer, padecimientos hereditarios como la distrofia muscular de Duchenne e infecciones virales, entre otras (Jiang y Doudna 2017; Doudna 2020).
Utilizando esta metodología se han establecido diversas líneas celulares, así como modelos animales con varias modificaciones (mutaciones o eliminaciones en genes particulares) para estudiar su participación en diversas enfermedades. Se han desarrollado estrategias para corregir genes en enfermedades monogénicas (un gen involucrado) y multigénicas (más de un gen involucrado). Las enfermedades en las que se ha usado esta tecnología incluyen: fibrosis quística, beta talasemia, anemia falciforme, hemofilia y la enfermedad de Huntington, ya sea haciendo la corrección en zigotos o en células troncales pluripotenciales inducidas (Zhang et al., 2016). Adicionalmente, debido a que el mantenimiento de modelos animales resulta costoso y las líneas celulares no reconstruyen el microambiente de células comprometidas a un linaje celular, se han utilizado los organoides, que son cultivos tridimensionales de células troncales embrionarias o células troncales pluripotentes inducidas, derivadas de pacientes que exhiben características de órganos completos. Estos organoides pueden ser editados por CRISPR/Cas9 y se puede estudiar el efecto de cada mutación causante de una enfermedad al ser trasplantados en animales. En cáncer se ha analizado el efecto de la edición en tumorigénesis, donde se ha podido encontrar, por ejemplo, que mutaciones en el gen p53 (editadas por CRISPR/Cas9) hace a este organoide sensible al inhibidor nutlin-3a, permitiendo dar tratamiento a personas que tienen mutaciones en este gen. Alternativamente, como parte de la terapia personalizada, los organoides derivados de pacientes con alguna enfermedad pueden ser editados por CRISPR/Cas9, es decir, el gen defectivo puede ser corregido y el organoide puede implantarse en el paciente (Baliou et al., 2018). Esta metodología se ha aplicado también en la modificación de células del sistema inmune para que sean más efectivas en destruir células cancerosas y agentes infecciosos. Por otro lado, se desarrollan drogas para tratar enfermedades del corazón, de la sangre y para la ceguera. Además del impacto de esta tecnología en la investigación biomédica, se ha utilizado ampliamente en la investigación en plantas para el mejoramiento de cultivos, haciéndolos resistentes a diferentes condiciones, con una transformación de la agricultura.
Uno de los principales riesgos de la metodología CRISPR/Cas9 es que el sistema no es 100% exacta; la nucleasa Cas9 puede realizar cortes inespecíficos en regiones diferentes a la que se desea modificar, lo cual puede causar cambios en genes no deseados y por lo tanto se puede causar daño y enfermedades graves. Existen reportes sobre daños producidos por el sistema CRISPR/Cas9 en animales, vegetales y células humanas. Para contravenir estos efectos, se han explorado estrategias para disminuir el riesgo de inespecificidad, encontrándose que al aumentar la especificidad de Cas9 por su sitio blanco y disminuir su actividad de nucleasa, se obtienen resultados promisorios.
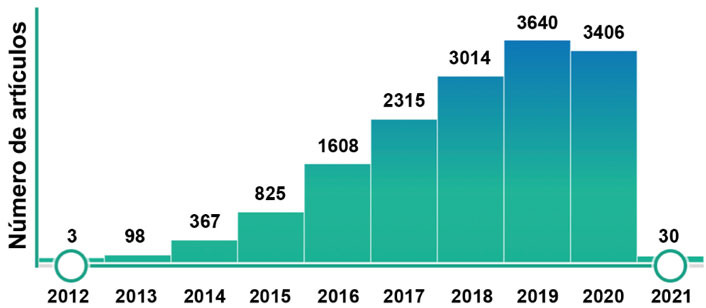
Al menos un grupo de investigación ha reportado el uso de CRISPR/Cas9 en embriones humanos, investigaciones que han causado una gran polémica en el mundo por las implicaciones éticas que esto tiene. En la actualidad, la búsqueda de las palabras “CRISPR Cas9” en PubMed (https://pubmed.ncbi.nlm.nih.gov/), una base de datos de publicaciones científicas arroja más de 15 mil trabajos relacionados con este tema, de los cuales, la gran mayoría han sido publicados después de 2012 (Figura 3). Estas publicaciones ponen en evidencia el impacto que ha tenido la tecnología CRISPR/Cas9 en el desarrollo de la ciencia en el planeta; sin embargo, debido al inmenso número de aplicaciones que tiene esta metodología como herramienta de ingeniería genética es indispensable que se utilice con responsabilidad y es urgente elaborar regulaciones para su aplicación.
Glosario
Bacteriófagos: Virus que infectan a las bacterias.
Endonucleasa: Enzima que corta ácidos nucleicos (DNA o RNA).
Knockout: Eliminación total de la expresión de un gen.
Locus: Posición que ocupa un gen o una secuencia particular dentro del genoma.
Operón: Región dentro del genoma que agrupa varios genes.
Protoespaciador: Secuencia proveniente de un bacteriófago o plásmido que se integra en la región CRISPR.
Trans-activadores: Moléculas de RNA que activan la función de otras moléculas, actúan en “trans”.
Zigoto: Célula resultado de la unión de un gameto masculino y un gameto femenino en la reproducción sexual de los organismos.
Referencias
Baliou S, Adamaki M, Kyriakopoulos AM, et al. CRISPR therapeutic tools for complex genetic disorders and cancer (Review). Int J Oncol. 2018, 53(2):443–468.
Charpentier E. CRISPR-Cas9: how research on a bacterial RNA-guided mechanism opened new perspectives in biotechnology and biomedicine (Review). EMBO Mol Med. 2015, 7(4):363–365.
Doudna JA. The promise and challenge of therapeutic genome editing (Review). Nature. 2020, 578(7794):229–236.
Doudna JA, Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9 (Review). Science. 2014, 346(6213):1258096.
Jiang F, Doudna JA. CRISPR-Cas9 Structures and Mechanisms (Review). Annu Rev Biophys. 2017, 46:505–529.
Jiang F, Doudna JA. The structural biology of CRISPR-Cas Systems (Review). Curr Opin Struct Biol. 2015, 30:100–111.
Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012, 337(6096):816–21.
Kamruzzaman M, Iredell JR. CRISPR-Cas System in Antibiotic Resistance Plasmids in Klebsiella pneumoniae. Front Microbiol. 2020, 10:2934.
Zhang H, McCarty N. CRISPR-Cas9 technology and its application in haematological disorders (Review). Br J Haematol. 2016, 175(2):208–225.
Fuente: Revista Avance y Perspectiva

