Más allá de Mendeléyev: La Tabla de Nucleídos
Kurt Bernardo Wolf
Instituto de Ciencias Físicas, UNAM. Miembro de la Academia de Ciencias de Morelos
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos
El martes 29 de enero se dio el lanzamiento del año 2019 como “Año Internacional de la Tabla Periódica de Elementos Químicos” por la UNESCO, para celebrar los 150 años desde su presentación formal en 1869 ante la Sociedad Química Rusa en San Petersburgo, por el Dr. Dmitrii Mendeléyev (1834—1909). En esta tabla, los elementos químicos se organizan por columnas según su valencia, y en renglones por su peso atómico.
Las columnas con la misma valencia caracterizan elementos con reactividades químicas similares, determinada por su número de electrones en órbita, que es igual a su número de protones en el núcleo. Agrupa, por ejemplo, los elementos alcalinos en su primera columna (hidrógeno, litio, sodio, potasio, rubidio, cesio), y los elementos alógenos en su séptima columna (flúor, cloro, bromo, iodo). Entre ellos, tienen la fuerte tendencia de formar moléculas con un átomo de cada una de estas dos columnas (como el cloruro de sodio = sal, el fluoruro de potasio, etc.). Esta tabla pone en orden las propiedades químicas que derivan de la estructura externa de los átomos, como fue explicado hace poco en esta columna.
El peso atómico de cada elemento, por otra parte, se refiere al núcleo del átomo: es el número (promedio) de protones más neutrones de un elemento. Éste se puede medir gracias a un dispositivo inventado en 1912 por Joseph Thomson, llamado espectrómetro de masas, donde un chorro de vapor del elemento se hace pasar por luz ionizante –que despide uno o más de sus electrones, de modo que los átomos quedan con una carga eléctrica neta; a continuación se hacen pasar por un campo magnético que da a su trayectoria una curvatura proporcional a su carga e inversa a su masa, registrando en una placa fotográfica su posición final. Aunque no se mide el peso absoluto de los productos, se conoce así el peso relativo a núcleos de otros elementos.
Organizados con valencia y peso atómico, la Tabla de Mendeléyev dio orden y sentido a la pluralidad de elementos químicos. Quedó para los físicos teóricos de principios del siglo XX la tarea de explicar los niveles energéticos observados cuando la nube electrónica se perturba desde su estado base. Los estudios realizados por Werner Heisenberg y Erwin Schrödinger del más simple de los elementos –el Hidrógeno, con un solo electrón en órbita– dio origen a la mecánica cuántica durante los años 20s, dilucidando la física atómica, mientras que la dinámica del núcleo del átomo, proporcional al tamaño de un balón en un estadio, seguía siendo un misterio.
Una Tabla Periódica para los núcleos de los elementos
Siempre en búsqueda de nuevos problemas, los científicos, armados con otros dispositivos, como la cámara de niebla desarrollada por Charles Wilson y Arthur Compton, vieron que no solamente protones había en el núcleo, sino también otras partículas neutras: los neutrones, caracterizados por James Chadwick en 1932. Esto explicaba por qué los pesos atómicos registrados no eran siempre números enteros: había mezclas de varios isótopos de cada elemento, que diferían entre sí por el número de neutrones. Esto no altera su actividad química, pero sí, muy ligeramente, su comportamiento físico.
La física nuclear fue desarrollada durante los años 30s y 40s, dando como resultado público las armas nucleares que terminaron la Segunda Guerra en agosto de 1945, validando varias otras ramas de la ciencia alrededor del estudio del núcleo, como la relatividad y la mecánica cuántica, abriendo nuevas y difíciles preguntas sobre el comportamiento de la materia. Por principio, si hay muchos protones con cargas positivas en el núcleo, y cargas iguales se repelen, ¿cómo es que hay núcleos estables? La pista está en los neutrones: éstos y los protones comparten una fuerza atractiva, llamada simplemente fuerza fuerte, que no distingue entre los dos tipos de partícula, y que es suficiente para mantenerlos unidos a distancias muy cortas. Para mantener la estabilidad, cuando el número de protones es grande, el número de neutrones tiene que ser un poco mayor para contrarrestar la tendencia repulsiva entre las cargas positivas.
Estudiando el núcleo mediante modelos
La descripción del núcleo atómico es más compleja que la estructura de su envolvente de electrones. Por principio, requiere un cálculo de interacción entre muchos cuerpos, no solamente entre pares de partículas. Durante los 50s y 60s del siglo XX se propusieron varios modelos para describir y predecir los niveles energéticos de los núcleos cuando son perturbados por agentes externos o por la inestabilidad inherente en sus configuraciones. Podríamos imaginarnos un núcleo, digamos el Oro-197 (escrito 197Au), como un hervidero de nucleones, 79 protones y 118 neutrones (79 + 118 = 197), cuya tendencia es agruparse en subconjuntos de 2 protones y 2 neutrones llamados Alfa. También existen núcleos de oro cuyo número de neutrones va de 115 a 120, pero éstos son inestables, con vidas medias de uno a diez días. Se pueden desintegrar emitiendo un Alfa, convirtiéndose en un núcleo de Iridio, o uno de sus protones puede mutarse en neutrón emitiendo un positrón (electrón positivo) y convertirse en un núcleo de Platino.
Cuando perturbamos estas bolas de nucleones impartiéndoles energía, podemos hacerlas rotar, vibrar y/o deformarse en elipsoides, o desintegrar. Para imaginar y comenzar a describir estos sistemas, se han propuesto modelos más sencillos que se puedan calcular con base en otros símiles físicos. Entre los modelos nucleares están los de la “gota de agua,” donde la rotación y la vibración de un cuerpo viscoso contienen los límites de su estabilidad. El símil físico está descrito por la mecánica cuántica, la cual pronostica las energías que pueden tener los estados excitados de cada núcleo –y que deben compararse con los resultados experimentales.
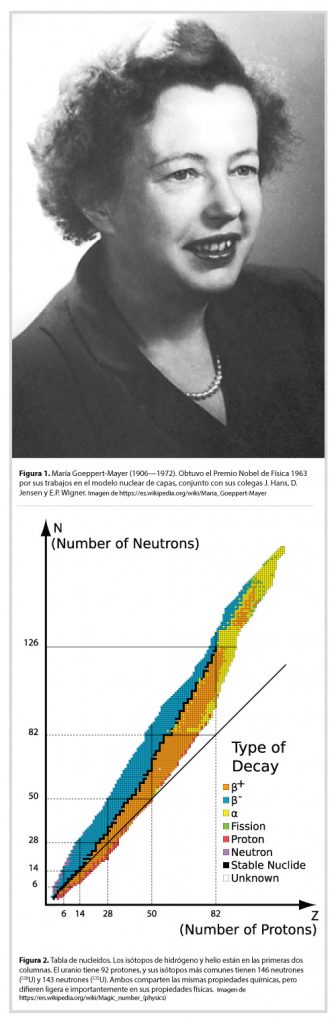
Otro modelo que es particularmente inclusivo, es el modelo de capas propuesto por María Goeppert-Mayer y sus colaboradores [6] en 1948 (Figura 1). Con este modelo se explicó por qué los núcleos con número de protones y/o de neutrones 2, 8, 20, 28, 50, 82 y 126 (nombrados “números mágicos” por Eugene Wigner) son particularmente estables ante perturbaciones, con base en un simple cálculo derivado del oscilador armónico: masas unidas a un resorte central –en versión cuántica. Otros modelos más refinados, usando las simetrías del oscilador compaginadas con simetrías impuestas sobre conjuntos de partículas idénticas e interacciones, logran predecir bastante bien la energía de estados excitados bajos en los núcleos. En el cálculo con estos modelos destacó el grupo del Dr. Marcos Moshinsky en el Instituto de Física de la UNAM y sus colaboradores, entre los años 60s y 90s.
Tabla de nucleídos y más allá
En la Figura 2 mostramos la Tabla de Nucleídos, que incluye los núcleos estables, así como los que se desintegran con diversas vidas medias. Los núcleos estables se encuentran mayormente sobre la diagonal, donde el número de neutrones es igual o mayor al de protones, hasta los números mágicos de 82 protones y 126 neutrones, que corresponden al Plomo 208Pb; éste es particularmente estable y se usa comúnmente como capa protectora contra radiaciones de nucleídos radiactivos. A ambos lados y adelante de la traza negra en la figura, los núcleos son inestables y se desintegran en diversos subproductos. El Uranio por ejemplo, tiene dos isótopos principales: el 238U con 99% de abundancia en la naturaleza y el 235U, con el 0.79% de abundancia natural. Ambos tienen 92 protones y vidas medias de ~ 4.4 mil millones y 700 millones de años, respectivamente. El 238U se desintegra espontáneamente emitiendo un Alfa y convirtiéndose en Torio-234, mientras que el 235U, cuando se perturba colisionándolo con un neutrón, el núcleo se rompe en un núcleo de Bario, uno de Kriptón, y tres neutrones; estos últimos pueden iniciar una reacción en cadena si la concentración de 235U’s es suficientemente alta. El enriquecimiento de este isótopo Uranio se lleva a cabo separándolo del más pesado y común 238U mediante centrífugas de alta velocidad.
Núcleos de masas mayores al Uranio se han producido mediante colisiones y son en general muy inestables, algunos con vidas medias de microsegundos. Se ha predicho –sin poderlo confirmar experimentalmente– que debe haber una “isla de estabilidad” alrededor de 114 protones y 184 neutrones. Y también, vale decir, los cálculos difieren en las observaciones de los estados energéticos más altos, evidencia que aún no se entiende completamente la dinámica nuclear.
Por supuesto, los científicos no cesan en buscarse problemas. A partir de los años 60s se encontró que protones y neutrones no son las únicas partículas elementales que provee la naturaleza: hay una plétora zoológica entre mesones (pi, rho, tau,…), hadrones (lambda, sigma, xi, omega,…) etcétera. La explicación se ha encontrado en sus subestructuras, donde participan varios tipos de quarks y leptones, en una Tabla más allá de las de Mendeleyev y de nucleídos, que se ha consolidado en el ahora llamado esquema estándar de partículas elementales. Estas subpartículas merecen ser explicadas de manera más detallada en otra publicación, la cual espero que el lector, espere con ansiedad.
Agradezco el apoyo del proyecto PAPIIT-UNAM IG100119.
El 2019 ha sido propuesto por la Organización de las Naciones Unidas como el Año Internacional de la Tabla Periódica de los Elementos por lo que la Academia de Ciencias de Morelos ha decidido dedicarle una serie de artículos preparados por especialistas de diferentes disciplinas. Sirva este artículo para despertar su curiosidad y que nos permitan compartir con ustedes nuestro amor por los elementos y su máxima representación, la Tabla Periódica.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Referencias
https://news.un.org/en/story/2019/01/1031532 https://en.wikipedia.org/wiki/Periodic_table#Groups http://www.acmor.org.mx/?q=content/la-qu%C3%ADmica-de-mi-vida https://www.livescience.com/20581-weigh-atom.html https://es.wikipedia.org/wiki/C%C3%A1mara_de_niebla#Bibliograf%C3%ADhttps://www.aps.org/publications/apsnews/200808/physicshistory.cfm https://en.wikipedia.org/wiki/Table_of_nuclides
Fuente: Academia de Ciencias de Morelos




