Las células cebadas y su papel en la inflamación
Daniel Guerrero Morán y Claudia González Espinosa
*Médico Cirujano de la Universidad Autónoma Metropolitana-Unidad Xochimilco y Maestro en Ciencias en Neurofarmacología y Terapéutica Experimental del Cinvestav-Sede sur. Actualmente inscrito en el programa de doctorado en el departamento de Farmacobiología, donde en el laboratorio de la Dra. Claudia González Espinosa comienza a desarrollar un proyecto para analizar el efecto de los DAMPs sobre vías de señalización de células cebadas y su posible participación en procesos tumorales.
**Investigadora Titular 3D y SNI III del departamento de Farmacobiología del Cinvestav. Su laboratorio se especializa en el estudio de los mecanismos moleculares de la respuesta inflamatoria y la transducción de señales de las células cebadas.
El sistema inmune comprende al conjunto de moléculas, células, tejidos y órganos encargados de defender al organismo contra agentes infecciosos (virus, bacterias, parásitos y hongos) y realizar labores de vigilancia contra células ajenas y tumorales, daño tisular, enfermedades autoinmunes y alergias. Cuando los elementos de este sistema brindan una respuesta efectiva y coordinada que mantiene la homeostasis, se puede hablar de una respuesta inmune exitosa. Estas respuestas del sistema inmune pueden ser innatas o adaptativas. Las primeras dependen de células y moléculas con las que nacemos y se mantienen relativamente constantes a lo largo de nuestra vida. Por otra parte, las respuestas inmunes adaptativas cambian dependiendo de los encuentros que nuestro organismo tenga con agentes patógenos o distintas moléculas extrañas (llamadas antígenos).
Una de las respuestas más importantes de la inmunidad innata es la inflamación. Ésta tiene como finalidad iniciar una respuesta de defensa contra patógenos y daño tisular. Usualmente es la primera en aparecer ante el reconocimiento de moléculas extrañas y, en su proceso de resolución, normalmente lleva a la reparación de las estructuras afectadas.
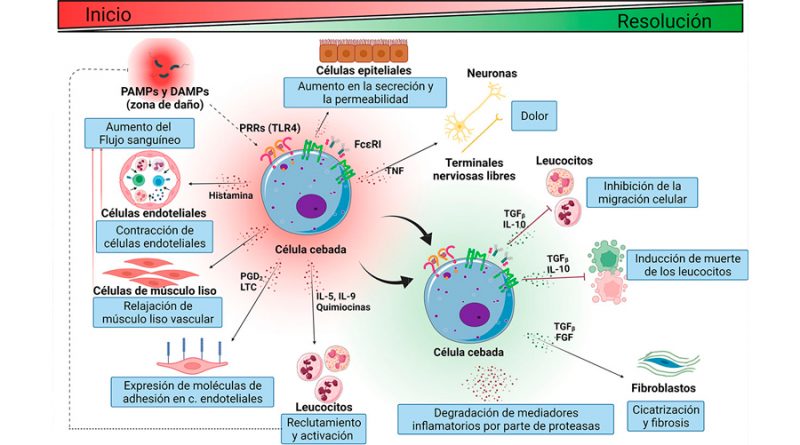
Cuando el daño ocurre en un tejido, las células inmunes residentes como las células dendríticas, los macrófagos y las células cebadas (CCs), reconocen la agresión, se activan y secretan mediadores que alertan a las células próximas. Tras la liberación de los mediadores inflamatorios, sucede una serie de eventos vasculares, hemodinámicos, neurológicos e inmunológicos. Por ejemplo, en los vasos sanguíneos, los mediadores con propiedades vasodilatadoras (como la histamina) inducen la relajación de las células de músculo liso de las arteriolas, además de la separación de las células endoteliales de los capilares. Ello conduce al aumento del flujo sanguíneo a la zona lesionada y al aumento de la permeabilidad de dichos vasos. Como consecuencia de los cambios vasculares, un exudado rico en proteínas plasmáticas como globulinas, fibrinógeno y moléculas del sistema del complemento sale en dirección al espacio intersticial. En este punto, algunos mediadores inflamatorios (como las prostaglandinas) activan a las terminales nerviosas cercanas ocasionando dolor, mientras que otros mediadores con capacidad quimiotáctica (como las quimiocinas) o pro-inflamatoria (como el factor de necrosis tumoral, TNF-α) inducen la expresión de moléculas de adhesión en las células endoteliales y se encargan de reclutar a leucocitos a la zona de lesión.
Todos los cambios descritos tienen como finalidad permitir que los leucocitos y las proteínas plasmáticas que llegan a la zona de daño, neutralicen y eliminen la agresión, reparando el tejido. En condiciones normales, la inflamación es un proceso transitorio que está estrechamente regulado, de tal forma que, durante la fase final de la respuesta (resolución), se establecen procesos celulares que contrarrestan los fenómenos iniciales. Para conseguirlo, algunas células reguladoras secretan interleucinas (ILs) como la IL-10 y el factor de crecimiento transformante β (TGF-β), que inhiben la migración de leucocitos, e incluso pueden inducir su muerte. También, en esta etapa, algunas enzimas liberadas al inicio de la respuesta comienzan a degradar los mediadores inflamatorios y otras proteínas, contribuyendo al término de la misma. Cuando la fase de resolución no es exitosa y la respuesta inflamatoria es demasiado intensa o prolongada, aparecen distintas enfermedades, dentro de las que podemos encontrar el síndrome de respuesta inflamatoria sistémica, la osteoartritis, la ateroesclerosis, la fibrosis de tejidos y diversas enfermedades metabólicas, entre otras. Cabe destacar que la respuesta inflamatoria cambia dependiendo de la edad del individuo, por lo que tiene características únicas en la vejez.
Debido a la importancia de la inflamación, algunas líneas de investigación se han enfocado en conocer las interacciones celulares y los procesos moleculares que tienen lugar durante escenarios fisiológicos y patológicos de este mecanismo de defensa. Gracias a ello, se ha podido extender nuestro conocimiento de los mecanismos reguladores de la inflamación, detallar eventos celulares y proponer potenciales blancos terapéuticos.
Las células cebadas participan en las distintas etapas de la inflamación
En décadas recientes, un tipo celular que ha cobrado relevancia dado su carácter regulador en las distintas etapas de la respuesta inflamatoria es la célula cebada (Figura 1). Las CCs (o mastocitos) se ubican en todos los tejidos del cuerpo, con especial abundancia en el tejido conjuntivo. Se caracterizan por tener un tamaño variable (de 5 a 20 µm) y presentar un aspecto granular debido a la presencia de abundantes vesículas intracelulares donde se almacenan distintos mediadores inflamatorios, como citocinas, factores de crecimiento, histamina, serotonina, derivados de ácido araquidónico y proteasas. Gracias a la capacidad de secretar ese amplio abanico de mediadores, las CCs pueden regular a las células circundantes en distintos puntos del proceso inflamatorio. Por ejemplo, al inicio y durante el establecimiento de la respuesta, las CCs secretan al TNF-α, histamina, prostaglandinas, leucotrienos, triptasa y otras proteasas con el objetivo de conducir a los fenómenos previamente descritos, mientras que, al final de la respuesta inflamatoria, las CCs secretan citocinas reguladoras como IL-10 y lípidos bioactivos, como endocannabinoides, con el objetivo de disminuir y detener los cambios iniciales y restablecer la homeostasis previa a la agresión.
Como otras células del sistema inmune, las CCs se forman durante el proceso de hematopoyesis. En el periodo embrionario y fetal, tal fase ocurre en la región mesonefros-aorta-gonadal, placenta, saco vitelino e hígado, mientras que, en el periodo postnatal, la hematopoyesis tiene lugar en la médula ósea. En el proceso surgen precursores de células cebadas (CCp) que migran hacia los distintos tejidos y terminan su diferenciación bajo la influencia de mediadores producidos localmente. Gracias a esta particularidad, el microambiente en el que culmina el proceso de diferenciación es especialmente relevante, dado que influye sobre la expresión de genes específicos y dota de un fenotipo particular a las distintas poblaciones de CCs maduras en los tejidos.
Tradicionalmente, las CCs son reconocidas por su participación clave en las reacciones alérgicas. Esto se debe en gran medida a su carácter secretor y que expresan de forma constitutiva al receptor de alta afinidad por la inmunoglobulina E (IgE), el FcεRI. En presencia de IgE aumenta la expresión del FcεRI y forma complejos con la inmunoglobulina. Cuando un antígeno específico es reconocido por la IgE se produce la agregación y activación de complejos IgE- FcεRI que conducen a la activación de vías de señalización al interior de la CC, que culminan en la producción de algunos mediadores inflamatorios y en la liberación intensa y rápida de los mediadores preformados y recién sintetizados en un proceso celular conocido como desgranulación anafiláctica. La liberación de los mediadores inflamatorios es la responsable de los signos clínicos inmediatos de las respuestas inflamatorias alérgicas, como rubor, edema, dolor y aumento de la temperatura local. En años recientes, se ha encontrado que estas células también participan en las respuestas inflamatorias de la inmunidad innata y están relacionadas con la aparición y progresión de enfermedades crónico-degenerativas.
Mecanismo molecular de reconocimiento y respuesta de las CCs ante el daño y la infección
Distintos estudios han mostrado la importancia de este tipo celular en la defensa contra diversos patógenos. Por ejemplo, diferentes cepas de ratones carentes de CCs son mucho más susceptibles de morir por infecciones con respecto a los ratones normales. Además, sabemos que las CCs tienen la capacidad para identificar a las moléculas producidas por el daño tisular. Éstas se han clasificado en dos categorías principales: aquellas denominadas “patrones moleculares asociados a daño” (DAMPs) y las llamadas “patrones moleculares asociados a patógenos” (PAMPs). Los DAMPs son moléculas endógenas que se producen como respuesta a un daño o salen de las células rotas (por ejemplo: proteínas mal plegadas, péptidos con formil-metionina, proteínas chaperonas, ácido desoxirribonucleico, etcétera). Por su parte, los PAMPs son elementos estructurales comunes en diferentes tipos de patógenos, como bacterias, virus, parásitos y hongos. Tanto DAMPs como PAMPs son reconocidos por un grupo de receptores denominados receptores de reconocimiento de patrones (PRRs). Por sus rasgos estructurales y mecanismos de señalización, los PRRs se han agrupado en familias, entre las cuales podemos encontrar a los receptores tipo Toll (TLRs), los receptores de lectina tipo C (CLRs), los receptores de tipo Nod (NLRs), los receptores tipo RIG-I (RLRs) y los receptores de productos de glicación avanzada (RAGE), entre otros. En las CCs se ha reportado, hasta ahora, la presencia de todos ellos. Cada familia de receptores parece participar en respuestas específicas, por ejemplo, los CLRs son importantes en la defensa contra los hongos, los NLRs intervienen en la detección de peptidoglicanos y otros compuestos bacterianos que entran a las células y los RLRs contribuyen a la detección de genomas virales.
Los TLRs son los PRRs mejor descritos hasta ahora en CCs. Estos receptores son un grupo de proteínas transmembranales que permiten el reconocimiento de un rango amplio de moléculas que incluyen: el lipopolisacárido (LPS) de las bacterias gramnegativas, el ácido lipoteicoico y el peptidoglicano (PGN) de las bacterias grampositivas, los lipoarabinomananos presentes en micobacterias, la flagelina y las lipoproteínas bacterianas, el ARN de cadena simple y el ARN de cadena doble de los virus, proteínas de choque térmico (HSP), fosfolípidos oxidados y proteínas que unen calcio (como las proteínas S100), por citar algunos ejemplos. La interacción entre los PRRs y sus ligandos es muy importante debido a que desencadena la activación de vías de transducción de señales al interior de las células e inician la inflamación. Por ejemplo, cuando una bacteria gramnegativa entra al organismo, las CCs pueden reconocer al patógeno gracias al TLR4 expresado en su membrana, lo que ocasiona la activación de vías de señalización que conducen a la expresión de genes, la producción de mediadores inflamatorios y cambios en la reorganización del citoesqueleto para la secreción del contenido vesicular y el movimiento celular. Gracias a ello, las CCs pueden iniciar y amplificar la respuesta inflamatoria y desencadenar los cambios vasculares, hemodinámicos, neurológicos e inmunológicos que la caracterizan.
El papel regulador de este tipo celular se ha observado también en la reacción inflamatoria desencadenada por el virus SARS CoV2, donde se ha detectado la activación de las CCs en distintos órganos de pacientes afectados, lo que contribuye a la tormenta de citocinas observada en el COVID-19. Finalmente, en la fase de resolución, las CCs pueden auxiliar en el decaimiento de la respuesta inflamatoria por medio de la secreción de IL-10 y proteasas.
A diferencia de la desgranulación anafiláctica inducida por la activación del receptor FcεRI, la secreción de mediadores activada por el TLR4 en las CCs ocurre debido a un mecanismo llamado secreción picemal, que consiste en la liberación de pequeñas vesículas desde los gránulos citoplasmáticos hacia el exterior de la célula y donde no existe fusión de los gránulos con la membrana plasmática.
Debido al importante papel modulador de las CCs en las distintas fases de la respuesta inflamatoria, este tipo celular es el blanco de múltiples investigaciones en el mundo; las más relevantes son: el control farmacológico de su activación en las alergias y los procesos moleculares que se activan por distintos PAMPs y DAMPs. En la actualidad, en el Cinvestav se investigan las vías de señalización que son activadas por los PRRs en las CCs, para generar conocimiento de frontera sobre su participación en la defensa contra patógenos, el crecimiento tumoral, la neuroinflamación y el envejecimiento, esperando desarrollar estrategias terapéuticas que permitan controlar el inicio de reacciones inflamatorias de alta intensidad que puedan dañar al organismo y ocasionen la aparición de enfermedades crónico-degenerativas, sin afectar las respuestas inflamatorias protectoras. Utilizando distintos modelos in vitro e in vivo, se han identificado moléculas nuevas que participan en el sistema de señalización del receptor TLR4 en ese tipo celular; descrito la síntesis de lípidos bioactivos que contribuyen a la resolución de la inflamación; y caracterizado el papel de las CCs en enfermedades crónicas cuyo riesgo se incrementa con la edad, como el crecimiento tumoral.
Glosario
Células ajenas: células que no expresan sobre su superficie a las moléculas de reconocimiento propias del individuo.
Espacio intersticial: espacio físico comprendido entre células, lleno de líquido y proteínas de sostén como colágeno y elastina.
Hematopoyésis: proceso de generación y desarrollo de células sanguíneas a partir de una célula precursora pluripotencial, que ocurre en tejidos específicos en las diferentes etapas del individuo.
Homeostasis: estado de equilibrio en los diversos procesos fisiológicos de un organismo que alude a un correcto funcionamiento del mismo.
Microambiente celular: conjunto de células, moléculas y estructuras que rodean a una célula puntual o a un espacio tisular concreto y forman un ambiente local altamente dinámico.
Patógeno: microorganismo capaz de provocar daño o enfermedad en otro organismo.
Región mesonefros-aorta-gonadal: región del mesodermo que se desarrolla durante el periodo embrionario de distintas especies como ratones y humanos. Es una región de suma importancia debido a que origina a las primeras células hematopoyéticas pluripotenciales de vida media larga para la vida postnatal.
Tejido conjuntivo: también conocido como tejido conectivo, es el tejido especializado que brinda sostén y cohesión a los demás tejidos del organismo.
Tormenta de citocinas: respuesta inmunológica descontrolada en la que se produce un exceso de citocinas de forma rápida y que desequilibra el correcto funcionamiento del organismo, generando enfermedad y teniendo el potencial de ser letal.
Bibliografía
Agier, J., Pastwinska, J., Brzezinska-Blaszczyk, E. (2018). An overview of mast cell pattern recognition receptors. Inflammation Research, 67, 737-746.
Dahlin, J., Hallgren, J. (2014). Mast cell progenitors: origin development and migration to tissues. Molecular Immunology, 63 (1), 1-9.
Duraisamy, K., Selvakumar, G.P., et al., COVID-19, Mast Cells, Cytokine Storm, Psychological Stress and Neuroinflammation. The Neuroscientist 26:402-414, 2020.
Espinosa-Riquer, Z.P., Segura-Villalobos, D., Ramírez-Moreno, Itzel G. Pérez-Rodríguez, M. J., Lamas, M., González-Espinosa, C. Signal transduction pathways activated by innate immunity in mast cells: translating sensing of changes into specific responses. Cells 9: 2411, 2020. Doi: 10.3390/cells9112411
Heazlewood, S., Nilsson, S., Cao, B. (2020). Advances in stem cells and their niches. Cambridge, United States: Elsevier.
Jimenez, M., Cervantes-García, D., Córdova-Dávalos, L. E., Pérez-Rodríguez, M.J., González-Espinosa, C. and Salinas, E. Responses of mast cells to pathogens: beneficial and detrimental roles. Front Immunol Jun 15; 12:685865, 2021. doi: 10.3389/fimmu.2021.685865.
Pastwinska, J., Agier, J., Dastych, J., Brzezinska-Blaszczyk, E. (2017). Mast cells as the strength of the inflammatory process. Polish Journal of Pathology, 68 (3), 187-196.
Serhan, C. N., Gupta, S. K., Perretti, M., Godson, C., Brennan, E., Li, Y., Soehnlein, O., Shimizu, T., Werz, O., Chiurchiù, V., Azzi, A., Dubourdeau, M., Gupta, S. S., Schopohl, P., Hoch, M., Gjorgevikj, D., Khan, F. M., Brauer, D., Tripathi, A., Cesnulevicius, K., … Wolkenhauer, O. (2020). The Atlas of Inflammation Resolution (AIR). Molecular aspects of medicine, 74, 1-22.
Fuente: Revista Avance y Perspectiva