Hugo A. Barrera Saldaña
De la bioquímica a la biología molecular para acceder a las biomoléculas de la herencia
Desde la adolescencia me interesé en los secretos de las células, por lo que, al decidir qué carrera estudiar, opté por combinar la de biólogo con la de Químico Biólogo Parasitólogo y asistir a cursos de posgrado afines a la bioquímica y la genética.
Mi primera oportunidad en el trabajo experimental llegó al desarrollar la tesis de licenciatura [1] en un tema que buscaba aislar y caracterizar ADN, ARN y proteínas. Ello, a partir de núcleos de las células de placenta humana −la cual se convirtió en mi principal modelo experimental−. Estudié la síntesis de ARN a partir de ADN (proceso conocido como transcripción) y la de proteínas a partir del ARN (proceso conocido como traducción). Esta primera maravillosa experiencia en la investigación biomédica, en particular en la Biología Molecular, acrecentó mi interés en el estudio de tales biomoléculas en células humanas. Posteriormente desarrollé un doctorado en la Universidad de Texas en Houston y luego un postdoctorado en la Louis Pasteur de Estrasburgo, Francia). (Figura 1).

Biología Molecular recargada con el poderío del ADN recombinante
Fue así como entré de lleno al mundo de la investigación de células humanas, principalmente, para entender cómo funcionan las unidades de nuestra herencia: los genes. En esencia, nuestra herencia está codificada en nuestro genoma, que es el conjunto de genes particulares que cada especie posee y que funciona como un sistema operativo desde donde se gobiernan el desarrollo y funcionamiento de nuestro cuerpo [2]. Sin embargo, el abordar estas investigaciones desde la bioquímica y la genética (previo de la invención de las técnicas del ADN recombinante), se concebía como un sueño de la investigación biomédica aún inalcanzable.
Hay que considerar que, hasta entonces, el modelo por excelencia en el que se estaban desarrollando las técnicas de la biología molecular, eran las bacterias, cuyo genoma es mil veces más pequeño que el nuestro. Fue gracias a que durante mis estudios doctorales tuve la oportunidad de entrenarme y aplicar la tecnología del ADN recombinante [3], que dicho sueño empezó a cristalizarse, tras iniciar mi carrera, ya de regreso a mi país.
La meta que les propuse a mis colaboradores y estudiantes fue la de entender cómo es que los genes están organizados, funcionan, son controlados y pueden ser aprovechados en favor de más y mejor salud para nuestros conciudadanos.
Aprovechamiento de la tecnología del ADN recombinante con fines de innovación terapéutica
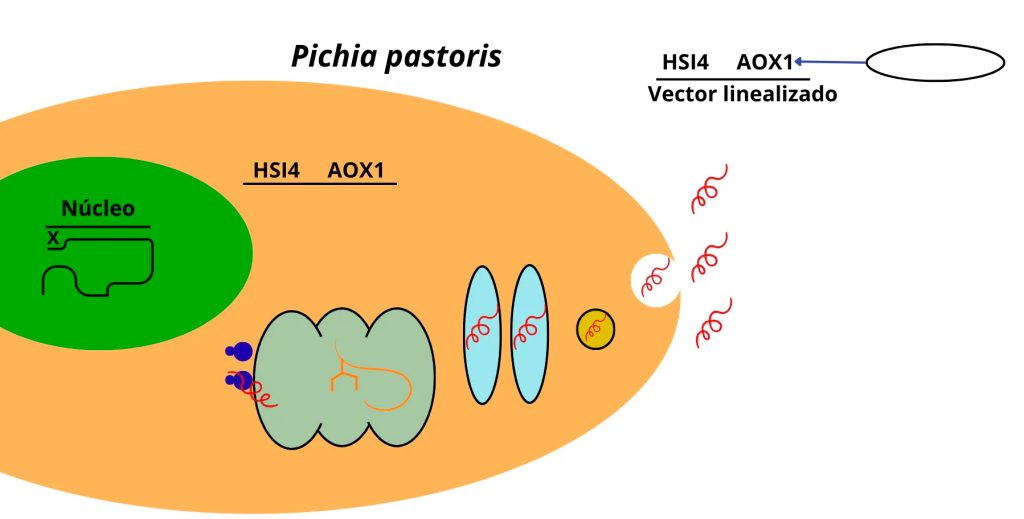
Con el surgimiento, a inicios de la década de 1970, de la tecnología de recombinación del ADN, también referida como clonación molecular o ingeniería genética [3, 4], en mi laboratorio adquirimos la capacidad de usar las biomoléculas de la herencia con fines terapéuticos. Con dicha capacidad, y buscando ayudar a infantes con retraso en el crecimiento, usamos al gen de la hormona del crecimiento (HGH, abreviación del inglés Human Growth Hormone) para reprogramar genéticamente a levaduras para que lo transcribieran hacia ARN mensajero y a éste lo tradujeran en proteína (en este caso, en HGH) que, por resultar de la aplicación del ADN recombinante, se le refiere como recombinante o biosintética (Figura 2). Junto con mis coinventores, patentamos esta invención y luego la Universidad Autónoma de Nuevo León (UANL) la licenció a una biofarmacéutica mexicana.
Aprovechamiento de la tecnología del ADN recombinante con fines de innovación diagnóstica
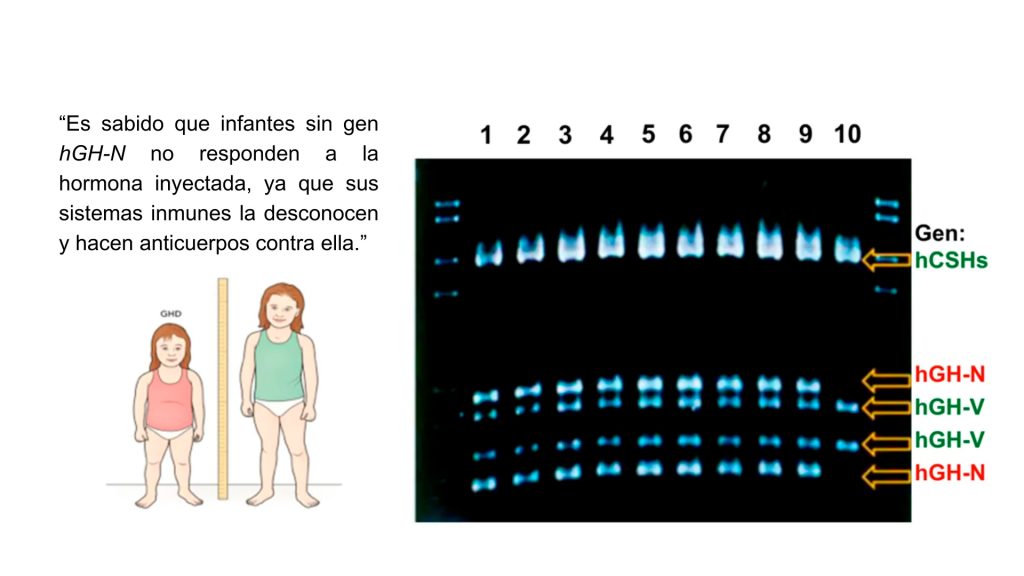
Se descubrió, sin embargo, que en tanto que la mayoría de los infantes con retraso en el crecimiento respondían bien al tratamiento, otros pocos no lo hacían. Buscando una explicación a este enigma, nos percatamos de otros casos que se habían reportado en la literatura científica, en los que se hipotetizaba que se debían a que carecían del g en responsable de la síntesis de la hormona HGH, conocido como el gen hGH-N o hipofisiario.
Procedimos a inspeccionar, con herramientas de la bioinformática (sobre esta tecnología, ver: BiotecMov No. 2[[M1]](# msocom1) ), a las secuencias del agrupamiento génico del genoma o locus donde se encuentra el gen hGH-N hipofisiario (junto con otros cuatro; uno más del tipo hGH pero referido como hGH-V o placentario y tres del tipo hCSH) y que habíamos secuenciado en su totalidad, lo que constituyó un récord mundial y el antecedente directo para el Proyecto del Genoma Humano. [5].
Ello nos permitió diseñar una prueba diagnóstica a base de la reacción enzimática conocida como en cadena de la polimerasa o PCR (por sus siglas en inglés y que se volvió muy popular durante la pandemia de la COVID, ya que como en cada ciclo duplica al gen objetivo o diana, a la vuelta de una veintena de ciclos, se generan millones de copias de este, facilitando enormemente su detección), para amplificar a los cinco genes del locus. Y para determinar de entre los cinco productos amplificados la presencia específicamente del amplicón del gen hGH-N, recurrimos a usar una “enzima de restricción” (que son como tijeras moleculares que cortan el ADN en regiones muy particulares), que se predijo debería actuar sobre los genes tipo hGH (dejando intactos a los hCSHs) cortándoles de diferente manera, lo que, analizando el patrón de bandas derivadas de la digestión, permitiría confirmar o descartar la presencia del gen hipofisiario.
En los infantes que carecen de este gen (y, por lo tanto, su cuerpo nunca ha visto a la HGH), al administrarles la versión biosintética de ésta, desarrollaban anticuerpos contra la misma y por tanto neutralizan el tratamiento. Tal prueba resultó ser la primera prueba de acompañamiento ( companion diagnostics o CDx) para un tratamiento, desarrollada en la era genómica, campo que ahora se conoce como de la “medicina personalizada” [6]. Un ejemplo de la aplicación en la clínica de esta prueba diagnóstica se muestra en la figura 3, cuya leyenda ahonda en su descripción metodológica.
Combatiendo el cáncer mediante ingeniería genética
Como reportamos en la revista científica J Gene Med. (7), logramos construir un virus “híbrido”, “ensamblado” con partes de un adenovirus y el virus del papiloma humano, el cual resultó capaz de multiplicarse selectivamente en células cancerosas del cuello cervicouterino.
Cuando administramos tal virus a ratones a los que se les habían trasplantado tumores en sus dorsos (provenientes de células cancerosas del cuello cervicouterino), comprobamos su acción oncolítica (esto es, que destruye las células cancerosas), al constatar la reducción del tamaño del tumor. Más aún, resultó sorprendente que, aunque tal efecto se apreció claramente en el tumor tratado, en un segundo tumor -implantado, pero no tratado con el virus- (para que sirviera de control o testigo), también se constató el efecto antitumoral del virus, concluyendo que el virus que había “escapado” del tumor tratado, había alcanzado al otro, para también atacarlo.
A partir de estos ensayos preclínicos de terapia génica contra el cáncer, fuimos invitados por colegas del Colegio Baylor de Medicina de Houston (más específicamente de su Hospital de la Niñez) para participar en un proyecto, ya a nivel clínico.
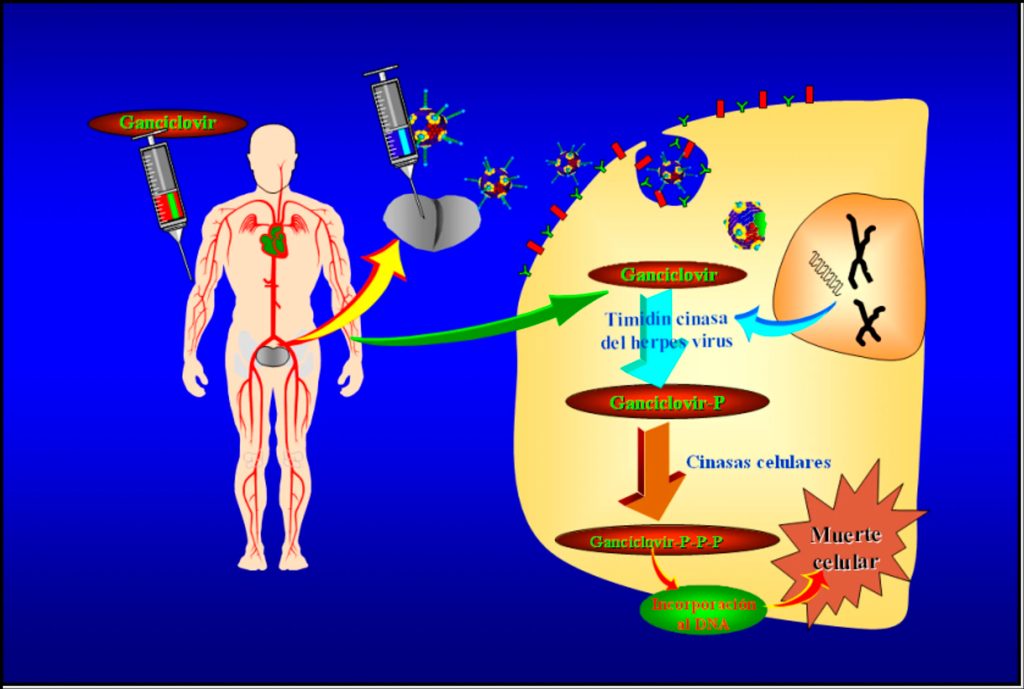
Este ensayo en pacientes de Monterrey, con el que inauguramos la era de la terapia génica en Latinoamérica (8), consistió en administrar a pacientes con cáncer de próstata en etapas iniciales, otro virus híbrido (también a base de un adenovirus), pero que en este caso portaba un gen para una enzima viral capaz de producir -en las células inyectadas- una enzima ausente en las células humanas, que permitía convertir un medicamento que se les administró a los pacientes, en una molécula confundible con un nucleótido (los nucleótidos son los bloques de construcción del ADN), el cual, cuando se incorporaba accidentalmente en la replicación celular, la frenaba, ocasionando la muerte de dicha célula. Esta muerte celular liberaba antígenos (moléculas que generan una respuesta inmune) que son distintivos del proceso maligno de esas células cancerosas, mismos que el sistema inmune reconocía y, por ende, le servía para detectar y atacar a las células cancerosas que hubieran escapado a la inyección viral (figura 4).
Impactos de la tecnología de ADN recombinante en el innovación diagnóstica y terapéutica
Nuestro laboratorio diseñó la prueba diagnóstica de acompañamiento para el tratamiento de la deficiencia de la HGH. Hoy en día, numerosas otras pruebas han sido y siguen siendo desarrolladas por laboratorios y empresas alrededor del mundo, para apoyar el diagnóstico de una gran cantidad de padecimiento hereditarios y adquiridos, así como para predecir el éxito de sus tratamientos. Asimismo, una multitud de genes han sido usados para producir proteínas terapéuticas (ver “Transgénicos”, libro coordinado por F. Bolívar), dotándole a la medicina de un poderoso y muy versátil armamento de medicamentos recombinantes, para tratar una amplia y cada día más creciente gama de enfermedades. Finalmente, tras algunos tropiezos, la terapia génica contra el cáncer está de vuelta con enorme fuerza y potencializada ahora con agentes que activan a las células del sistema inmune para en forma sinérgica combatir y, esperemos pronto, vencer al cáncer.
Referencias
- Barrera-Saldaña, HA. (1979). Aislamiento y caracterización de núcleos de placenta humana. Tesis de Licenciatura. Facultad de Ciencias Biológicas de la UANL. Monterrey, NL. México.
- Barrera-Saldaña HA. (1998). Growth hormone and placental lactogen: biology, medicine and biotechnology. Gene. 211:11-8.
- Barrera-Saldaña, HA. (1992). Información genética. Su estructura, función y manipulación. Colección Ciencias Básicas. CONACyT. México.
- Watson JD, Tooze J & Kurtz, DT. (1983). Recombinant DNA: A short course. Scientific American books. WH Freeman press. New York.
- Roberts, LA. (1988). Sequencing reality check. Research News. Science. Dic. 2, p. 1245.
- Barrera-Saldaña HA. (2019). Origin of personalized medicine in pioneering, passionate, genomic research. Genomics, 112:721–728.
- Delgado-Enciso I, Cervantes-García D, Martínez-Dávila IA, Ortiz-López R, Alemany-Bonastre R, Silva-Patas CI, Lugo-Trampe A, Barrera-Saldaña HA, Galván-Salazar HR, Coronel-Tene CG, Sánchez-Santillán CF, Rojas-Martínez A. (2007). A potent replicative delta-24 adenoviral vector driven by the promoter of human papillomavirus 16 that is highly selective for associated neoplasms. J Gene Med., 9:852-61.
- Rojas Martínez A, Manzanera AG, Sukin SW, Esteban María J, González Guerrero JF, Gómez Guerra L, Garza Guajardo R, Flores Gutiérrez JP, Elizondo Riojas G, Delgado Enciso I, Ortiz López R, Aguilar LK, Butler EB, Barrera-Saldaña HA, Aguilar Cordova E. (2013). Intraprostatic distribution and long-term follow-up after AdV-tk immunotherapy as neoadjuvant to surgery in patients with prostate cancer. Cancer Gene Ther., 11:642-9.
Lecturas recomendadas
- Barrera-Saldaña HA. (2020). Los siete magníficos … ¡emprendimientos Bio! CIENCIA UANL, 100:18-31. https://cienciauanl.uanl.mx/?p=9859
- Sánchez-Flores, A. (2015). Biotecnología en movimiento. Secuenciación Masiva y Bioinformática, 23–24. https://biotecmov.ibt.unam.mx/services/pdfDownloader.php?id=MioqXyoqMTA=
- Carlos Federico-Arias Ortiz F, Arteaga-Vázquez M, Barrera-Saldaña HA, et al. (2017). Transgénicos: Grandes beneficios, ausencia de daños y mitos. Academia Mexicana de Ciencias. http://coniunctus.amc.edu.mx/libros/TransgenicosCoordinadorFBolivar.pdf
Fuente: biotecmov.ibt.unam.mx

