La piel del hielo
Nicté Luna
Instituto de Energías Renovables, UNAM
Yo sólo quería escribir un artículo de divulgación para explicar por qué el hielo es resbaladizo, inspirada en las fascinantes presentaciones de los competidores de patinaje sobre el hielo que participaron en los pasados juegos olímpicos de invierno; pero me encontré que esa es una pregunta que ha mantenido ocupada la mente de científicos desde el siglo XIX, y que es un tema que sigue provocando controversias en el mundo actual de la investigación científica. En las siguientes líneas esbozo las teorías que se han propuesto para explicar por qué el hielo es resbaladizo.
Los amantes de los deportes sobre hielo pueden deslizarse sobre la plancha de agua congelada gracias a la presencia de una capa delgada de agua “líquida” que hace la función de lubricante para que el patín se mueva. Esa capa es la que ha despertado la curiosidad de los investigadores, pues resulta asombroso que esté presente aún cuando la temperatura del hielo está entre los -8 y -10 grados Celsius (°C), también conocidos como centígrados, muy por debajo del punto de fusión (0°C). Los patinadores pueden deslizarse sin ningún problema aún a temperaturas muy por debajo de la temperatura a la que suponemos que todas las moléculas del agua han adoptado la estructura del sólido.
Para entender porqué el hielo se puede derretir a temperaturas bajo los 0ºC, recordemos las fases de la materia. Desde niños sabemos que la materia tiene distintas fases: líquida, sólida y gaseosa; y que una substancia puede cambiar su estado físico si modificamos su temperatura (T). Esto lo aprendemos muy bien porque en nuestra vida cotidiana observamos los cambios de fase del agua. Más adelante aprendemos que la transición de una fase a otra también depende de las condiciones de presión (P) a la que se someta una substancia, además de la temperatura. Es por ello que la temperatura de ebullición del agua en Cuernavaca (95oC) no es la misma que en Acapulco (100oC) ya que en este último, la presión atmosférica es más alta que en Cuernavaca que se encuentra a 1800 m snm.
¿Por qué sucede esto con el agua? ¿Es lo mismo para todas las substancias? ¿Bajo qué condiciones de presión y temperatura se da el cambio de fase de sólido a líquido del agua? En las siguientes líneas responderé a estas preguntas.
El agua tiene un comportamiento muy raro
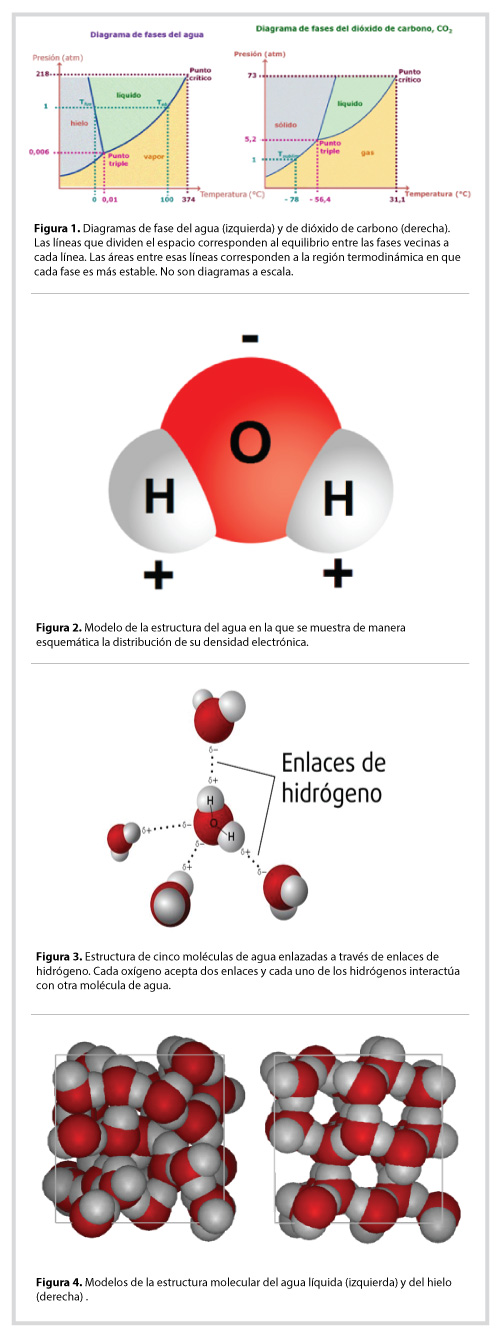
Al estudiar las propiedades de la materia, los científicos han encontrado que cada substancia se comporta de manera particular ante los cambios de presión y temperatura. Con cuidadosas mediciones experimentales han logrado construir el diagrama de fases de muchas substancias. En la figura 1 se muestran el del agua y el del dióxido de carbono. Cada una de las líneas que separan los diferentes sectores del diagrama representa el par de condiciones (P,T) en el cual las dos fases coexisten.
Ahora, fijémonos en la línea que separa a la fase sólida de la líquida en ambos casos. Está inclinada en direcciones diferentes y poquísimas substancias presentan un comportamiento similar al del agua. Explicamos ahora el efecto que la dirección de esa línea tiene sobre las propiedades que nos interesan, el cambio de sólido a líquido. Sabemos que si tenemos un cubo de hielo a una presión igual a 1 atmósfera (la presión atmosférica al nivel del mar) su punto de fusión -es decir, la temperatura a la que se derrite- será 0ºC. Sin embargo, si aumentamos la presión sobre el cubo de hielo, contrario a lo que sucede con el dióxido de carbono, el punto de fusión sucederá a una menor temperatura.
El diagrama de fases del agua sugirió una primera explicación a la presencia de la capa “líquida” en la pista del hielo: cuando un patinador se desliza sobre ésta, ejerce una presión grande sobre el hielo y por lo tanto, el agua se funde bajo su presión.
Sin embargo, esta hipótesis no se sostiene cuando hacemos números. Véamos: para calcular la presión que el patín ejerce sobre la superficie del hielo recordamos que la presión es la fuerza que se ejerce sobre un área particular, en el caso que nos ocupa, el área de la navaja del patín que está en contacto con la superficie del hielo. Digamos entonces que el patinador pesa 60 kg y la navaja de sus patines mide 30 cm de largo y el ancho de la cuchilla del patín de hielo, suele ser de 1 mm de ancho. Eso resultaría en una presión 20 veces más grande que la que ejerce el aire y únicamente reduciría la temperatura de fusión en una décima de grado (Tfusión = -0.1ºC) Con lo que no parece suficiente para tener agua líquida en la superficie del hielo, sobre todo considerando que la temperatura de las pistas de hielo es varios grados bajo cero.
La cuchilla del patín fricciona el hielo
En 1939, los científicos Frank Philip Bowden y T. P. Hughes, de Cambridge, Inglaterra sugirieron que cuando un patín se mueve sobre la superficie del hielo, la fricción entre la cuchilla del patín y el hielo genera calor que derrite la capa más externa de hielo. Un ejemplo cotidiano en el que podemos percibir que la fricción de dos materiales genera calor, es cuando frotamos nuestras manos para calentarlas, y quitarnos el frío.
Para comprobar esto, Bowden y Hughes hicieron un experimento en una estación de investigación en Suiza; para mantener temperaturas por debajo de -3°C usaron CO2 sólido (hielo seco) y aire líquido. Empleando superficies de madera y metal, midieron los efectos de la fricción estática y cinética en la fusión del hielo. Llegaron a la conclusión de que el calentamiento por fricción era responsable de derretir el hielo.
Sin embargo, a pesar de que el calentamiento por fricción puede explicar por qué el hielo es resbaladizo cuando una persona entra con patines o con zapatos, queda una situación pendiente: ¿cómo es que el hielo puede ser tan resbaladizo incluso para alguien que permanece inmóvil sobre él, o incluso a -70 ºC? De ahí que exista una tercera posible explicación: la superficie del hielo es de por sí resbaladiza.
¿Por qué el agua tiene este comportamiento particular?
La respuesta se encuentra en la estructura molecular de esta sustancia. Recordemos que la molécula de agua está formada por dos átomos de hidrógeno (H) que tienen un electrón cada uno, y un átomo de oxígeno (O) con seis electrones, la famosísima ache-dos-o. Se le conoce como una molécula polar pues su densidad electrónica genera una zona con muchos electrones y otra con pocos. Se denomina polo negativo al tiene más electrones (en este caso es el oxígeno) y polo positivo al que tiene menos electrones (los hidrógenos), ver figura 2. Esta característica de la molécula del agua, provoca que el polo negativo (O) se oriente hacia el lado positivo (H) de otra molécula del agua, de ahí que a esta interacción molecular se le denomine “enlace de hidrógeno”, pues los átomos de hidrógeno actúan como enlace entre los átomos de oxígeno de otras moléculas de agua, ver figura 3. Las moléculas de agua se ordenan de tal modo que cada una de ellas puede asociarse con otras cuatro, como se da con el hielo, véase (http://www.acmor.org.mx/?q=content/el-pegamento-de-la-vida, https://www.youtube.com/watch?v=iqeaKpAEbyA)
Es por estos enlaces de hidrógeno que cuando metes una botella con agua al congelador, el envase se deforma, incluso puede explotar, esto es porque cuando se vuelve hielo, se expande. ¿Qué significa esto? En su estado sólido, las moléculas de agua se acomodan para formar una red ordenada, dejando huecos hexagonales, que son la causa de que el agua en este estado sea menos densa que en su estado líquido, es por ello que cuando pones hielos en un vaso con agua, estos flotan. En la figura 4 puedes observar mejor el cambio de estructura que ocurre al pasar del líquido al sólido.
Para entender mejor esto, retomemos que la molécula de agua se puede asociar con otras cuatro mediante los enlaces de hidrógeno. Al enfriar el agua se disminuye el movimiento de sus moléculas por lo cual un cubo de hielo está conformado por numerosas capas formadas por la red hexagonal de moléculas de H2O superpuestas una sobre otra. Las capas más interna del cubo de hielo tienen una estructura hexagonal ordenada, pero qué pasa con las moléculas que se encuentran en las capas más externas del cubo. El ambiente alrededor de ellas es diferente, no hay sobre ellas otras moléculas de agua. Las moléculas de la superficie son diferentes a las del interior del cubo de hielo debido a que les falta un vecino. Si la máxima posibilidad de vecinos es cuatro moléculas, las de la superficie están deficientes en vecinos. Esas ‘extremidades’ sin compartir hacen que esas moléculas sean ligeramente diferentes. ¿En qué son diferentes?
La respuesta está en las vibraciones y orientaciones que tienen los átomos. En cualquier estado de la materia, los enlaces en las moléculas vibran, es decir, se estiran, se encogen y se doblan. Cuando el agua se encuentra en su estado sólido, las moléculas vibran aún con las restricciones de la estructura enlazada a otras cuatro, pero, cuando está en la superficie quedan posiciones de enlaces de hidrógeno libres, por lo que en la superficie del cubo, la estructura molecular es desordenada, este comportamiento es más parecido al de agua en su estado líquido, sin ser exactamente igual.
Estas últimas capas en la superficie del hielo mantienen cautivados a los investigadores porque han observado que incluso a temperaturas por debajo de los -70oC el hielo tiene una capa de agua muy parecida a la superficie del agua líquida. Hay evidencias experimentales de que esta agua superficial, la piel del agua, no se comporta de la misma manera que el agua líquida en algunas reacciones químicas muy importantes. De ello les contaremos en una próxima entrega de esta “novela” de misterio en la que el agente –ache-dos-o- es el personaje principal.
Referencia
- Chang Q Sun y Yi Sun (2016). The Attribute of Water: Single Notion, Multiple Myths. Singapur: Springer
- Chang Q Sun (14 Feb 2015). Elastic Coulomb-levitation: why is ice so slippery? Cornell University Library. Disponible en: https://arxiv.org/abs/1502.04173
- James K. Beattie, Alex M. Djerdjev y Gregory G. Warr. “The surface of neat water is basic” Faraday Discuss., 2009,141, 31-39
Fuente: Academia de Ciencias de Morelos