¿Cómo pueden los vegetales evitar la corrosión?
José Gonzalo González Rodríguez, Elizabeth América Flores Frías, Edna Vázquez Vélez y Horacio Martínez Valencia
José Gonzalo González Rodríguez es físico por la Universidad Autónoma de Nuevo León. Tiene Maestría y Doctorado en Corrosión de Materiales por la Universidad de Manchester, Gran Bretaña. Trabaja sobre protección de materiales en el Centro de Investigación en Ingeniería y Ciencias Aplicadas, de la Universidad Autónoma del Estado de Morelos (UAEMor).
Elizabeth América Flores Frías es Ingeniera Química egresada de la FCQeI de la UAEMor. Posteriormente, cursó la Maestría y Doctorado en Ingeniera y Ciencias Aplicadas en la UAEmor. Actualmente, se encuentra haciendo su posdoctorado en el Instituto de Ciencias Físicas de Universidad Nacional Autónoma de México (UNAM) desarrollando síntesis de inhibidores de corrosión mediante plasma.
Edna Vázquez Vélez estudió la licenciatura, maestría y doctorado en Química en la Facultad de Ciencias Químicas de la Benemérita Universidad Autónoma de Puebla. Realizó un postdoctorado en el Centro Nacional de la Investigación Científica en Yves Sur-Yvette, Francia y actualmente trabaja en el Laboratorio de Espectroscopia del Instituto de Ciencias Físicas de la UNAM.
Horacio Martínez Valencia estudió la licenciatura, maestría y doctorado en Física en la Facultad de Ciencias de la UNAM. Actualmente, es Investigador Titular “C” del Instituto de Ciencias Físicas de la UNAM y es miembro activo de la Academia de Ciencias de Morelos.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos
Corrosión
La corrosión de los materiales es un proceso silencioso que causa muchos incidentes y pérdidas a la economía de un país. Es uno de los principales problemas provocado por un proceso natural. Pero ¿Qué es la corrosión? ¿Por qué se origina? ¿Y cómo podemos evitarla? Son algunas de las preguntas que contestaremos en este artículo. La corrosión es el deterioro que sufren los metales por estar en contacto con el medio ambiente, de ahí que es un proceso natural que no se puede evitar; no obstante, gracias al desarrollo de la ciencia se puede mitigar.
Los metales son materiales que se obtienen a partir de minerales extraídos del interior de la Tierra, por lo que en general no se encuentran en su estado puro, a excepción de algunos como el oro y el platino. En consecuencia, para la obtención de los metales en estado puro, debemos recurrir a su separación, lo que implica un gran aporte energético. Los metales en su forma natural se encuentran en forma de óxidos, sulfuros, carbonatos, etc. Desde hace milenios, el hierro fue encontrado en los yacimientos bajo la forma de óxido, que representa el estado más estable del hierro. Esta es la razón principal, por la que el hierro tiende a oxidarse, porque busca regresar a su estado natural, donde es más estable. El mineral de hierro más común es la hematita Fe2O3, por lo que no es de extrañarse que sea también el principal producto de la corrosión del hierro, que se conoce como herrumbre [1].
¿Qué significa que un metal se oxide?
Los metales al estar en contacto con el medio ambiente, o un líquido, inclusive con partículas derivadas de la contaminación ambiental, comienzan a sufrir un proceso de oxidación, que puede ser explicado a través de una reacción química conocida como óxido-reducción. Es una reacción simultanea donde una sustancia se oxida (pierde electrones) y por otra se reduce (gana electrones) [1]. En el proceso de oxidación de un metal, el agente oxidante es el medio y el agente reductor el metal. Los iones provenientes del medio quitarán electrones al metal, por lo tanto, el agente oxidante ganará estos electrones mientras que el metal los perderá. A este fenómeno de oxidación se le conoce como corrosión, lo que ocasiona que los metales se deterioren con los años. La oxidación por lo tanto es una reacción química donde un metal pierde electrones y aumenta su estado de oxidación, el cual dependerá de los electrones que perdió.
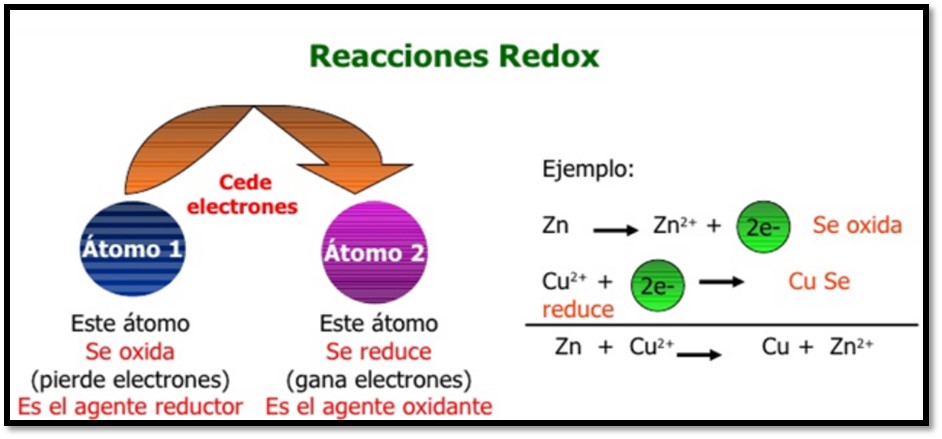
En la figura1 se muestra el ejemplo de una reacción redox (óxido-reducción), se puede observar que el átomo 2 representa el agente oxidante (gana electrones) que se reduce, mientras el átomo 1 el agente reductor que se oxida a consecuencia de ceder electrones al átomo 2. En el ejemplo, se analizan dos semirreacciones la oxidación del Zinc (Zn) y la reducción del Cobre (Cu). Los superíndices indican el número de oxidación de estos elementos, se observa que el cobre se encuentra como Cu^2+ actuando como el agente oxidante, que, al ganar dos electrones, su número de oxidación se reduce de 2^+ a 0. Mientras que el agente reductor pierde 2 electrones aumentando su número de oxidación de 0 a 2^+.
http://www.scielo.org.mx/img/revistas/eq/v29n3//0187-893X-eq-29-03-79-gf1.png
En la naturaleza se encuentran diferentes substancias aceptoras de electrones. Las más abundantes son el agua, el oxígeno y el hidrógeno (ácidos). Para que estas substancias corroan a los metales, estas se tienen que adherir o adsorber sobre los materiales o simplemente estar expuestas por tiempos prolongados sobre el metal. El grado de corrosión que sufrirá el metal dependerá de los métodos de control de corrosión para la protección de los materiales afectados. Una de las opciones para prevenir la adsorción del medio en el material es proteger al metal con una pintura o recubrimiento. Sin embargo, existen diferentes estructuras metálicas en funcionamiento que están expuestas continuamente a un medio corrosivo líquido, en estos casos la adición de algún inhibidor de corrosión al medio sería la solución.
Inhibidores de corrosión
Un inhibidor es una sustancia química que, al añadirse al medio corrosivo, disminuye la velocidad de corrosión [2]. Los inhibidoras de corrosión normalmente se utilizan en medios acuosos, un ejemplo es en los pozos petroleros. El tratamiento ácido a pozos de petróleo es uno de los procesos tecnológicos más corrosivos para instalaciones metálicas, el cual consiste en inyectarles grandes volúmenes de fluidos ácidos, para disolver parte de las rocas, aumentando su permeabilidad y la fluencia del petróleo. El uso de ácidos concentrados, elevada temperatura y tiempo prolongado, entre otros, hace imprescindible el uso de métodos de protección contra la corrosión, donde el más adecuado y difundido en la práctica mundial es la adición de inhibidores de corrosión a la receta ácida [3].
Imagina que necesitas utilizar un inhibidor para disminuir la corrosión en los pozos petroleros y te gustaría utilizar un inhibidor natural, poco costoso y no tóxico. Por ejemplo, las semillas de chía y linaza, las cuales son ricas en ácidos grasos, o las frutas y verduras, las cuales contienen grandes cantidades de antioxidantes. Estos antioxidantes y ácidos grasos son sustancias moleculares que pueden extraerse para ser utilizados como inhibidores. Otros ejemplos son el epazote, los residuos (asientos) del café, la cascarilla del arroz, el ajonjolí, eucalipto, jitomate, betabel, mamey, dátiles, el nopal, etc., todos ellos contienen sustancias activas que disminuyen la velocidad de corrosión del metal.
La forma molecular de los inhibidores de corrosión naturales
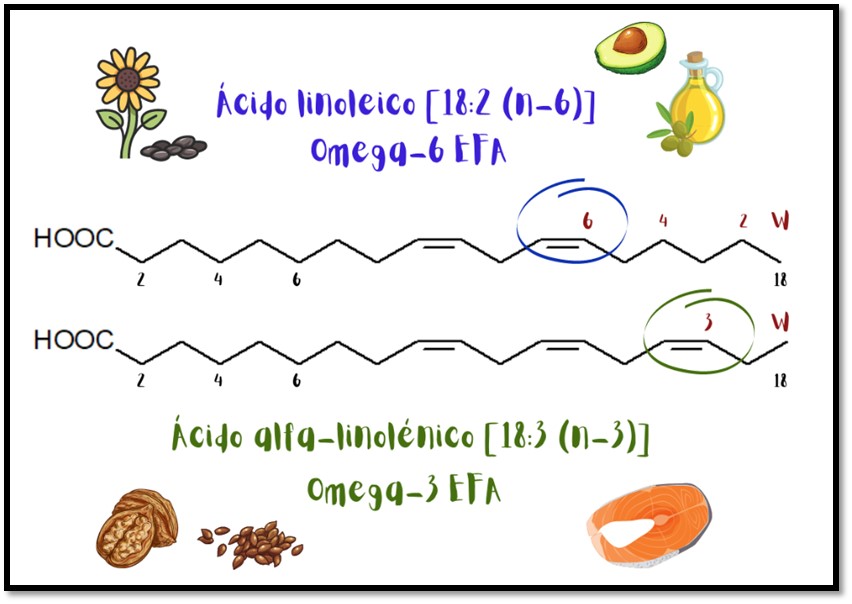
El omega-3 y el omega-6 son ácidos grasos, ambos tipos de grasas poliinsaturadas, lo que significa que poseen más de un doble enlace entre sus carbonos, como se observa en la figura 2. La diferencia está en dónde se produce el primero de los dobles enlaces. En los ácidos grasos omega-3, el primer doble enlace se produce en el tercer átomo de carbono, pero en los ácidos grasos omega-6, el primer doble enlace está en el sexto átomo de carbono [4].
https://mariamonterrubio.com/2022/03/04/por-que-los-acidos-grasos-omega-controlan-la-barrera-de-tu-piel/
Cada enlace representa dos electrones y, al analizar la estructura molecular del omega-3 y omega-6, se pueden observar dobles enlaces, lo que significa cuatro electrones de enlace en lugar de dos en un enlace simple. Esto quiere decir que son moléculas ricas en electrones por lo cual, al ser utilizadas como inhibidores de corrosión, ceden sus electrones al material para protegerlo del medio. Otra característica que tiene su capa lipídica, que las hace excelentes candidatas como inhibidores, es el carácter hidrofóbico (repele el agua) e hidrofílico (absorbe agua). Así, la parte hidrofóbica (cadena hidrocarbonada) repele el medio acuoso impidiendo el paso del agente oxidante hacia el metal, como un escudo. De esta manera, también reducirá la interacción agente oxidante – metal.
https://quimicaencasa.com/la-quimica-de-la-sandia/estructura-quimica-del-licopeno/
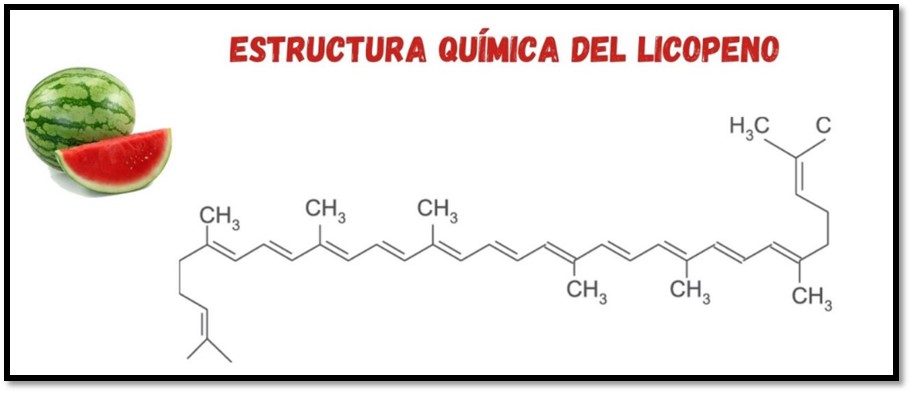
Un ejemplo de este tipo de inhibidores es el licopeno (figura 3) que se encuentra en la naturaleza como pigmento natural liposoluble responsable del color rojo y naranja de algunas frutas y verduras, que se caracteriza por poseer una estructura química de cadena abierta alifática formado por cuarenta átomos de carbono con trece enlaces dobles, por lo que es muy reactivo frente al oxígeno y a los radicales libres [5]. Esto quiere decir que el licopeno se adhiere a la superficie del metal a través de sus electrones para formar una capa protectora e impedir que el medio reaccione sobre la superficie metálica.
¿Cómo actúa un inhibidor de corrosión?
La acción de los inhibidores se realiza en dos procesos principales, el primero implica el transporte del inhibidor hacia la superficie del metal y el segundo implica la interacción entre el inhibidor y la superficie formando una capa.
La capa formada puede proteger la superficie del ambiente que lo rodea, o bien puede entregar sus electrones al medio que lo rodea para evitar el proceso de oxidación [6].
El fenómeno de corrosión es una de las principales causas de fallas en las instalaciones petroleras y la mitad de estas fallas están vinculadas a la corrosión debido la presencia de gases como CO2 y H2S [7].
Utilizar inhibidores de corrosión para reducir o controlar fallas en sistemas petroleros es de vital importancia, ya que implementar mantenimientos preventivos evita costos excesivos a un mantenimiento correctivo.
La figura 4 muestra un ejemplo de un inhibidor de corrosión utilizado en la industria petrolera en el cual la cadena de carbonos o cadena hidrocarbonada es hidrofóbica al igual que los hidrocarburos. Por esta razón se puede observar que no existe repulsión entre ellos. La sección frontal de la molécula inhibidora de corrosión está formada por un grupo amino de nitrógeno polar el cual tiene un par de electrones libres disponibles para enlazarse al metal. Lo que se observa en la imagen perteneciente a la sección polar de la molécula es la afinidad hacia el metal, con lo cual forma una capa protectora sobre él, mientras la sección hidrofóbica es la encargada de abrir paso o aproximar el grupo amino hacia el metal. De esta manera funcionan los inhibidores de corrosión, generando una capa protectora sobre el metal, la cual impedirá el paso del agente oxidante y por lo tanto la velocidad de corrosión disminuirá. Sin embargo, esto no será de forma definitiva, dado que la capa tenderá a ser removida o disolverse con el tiempo. Por esta razón, es muy importante el tipo de interacción que se origine, ya sea una quimisorción o una fisisorción. La fisisorción solo se genera superficialmente, esto quiere decir que solo se adhiere y puede ser removida con facilidad, mientras la quimisorción implica enlaces covalentes, lo cual origina que la capa protectora no pueda ser removida tan fácilmente, asegurando una protección prolongada.
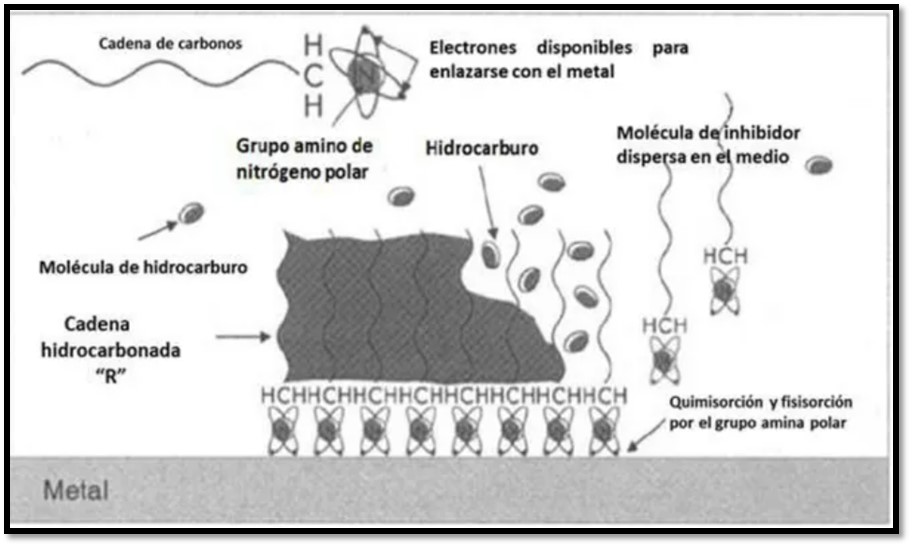
https://1library.co/document/q7w63enz-desarrollo-moleculas-inhibidoras-corrosion-metilimidazol-caracteristicos-fraccionamiento-catalitico.html
Conclusiones
Como se mencionó anteriormente la corrosión es un deterioro natural frecuente en toda industria (química, petrolera, marítima, de construcción civil, en los medios de transporte, los sistemas de comunicación, etc.). La mayoría de los compuestos utilizados para inhibir este deterioro son demasiado tóxicos, costosos y dañinos para el medio ambiente y el ser humano. Esto ha motivado a la investigación científica a buscar inhibidores de corrosión que sean ambientalmente amigables y de bajo costo. Actualmente los inhibidores naturales de corrosión son ampliamente utilizados en el control y prevención de este fenómeno. Los extractos de plantas son biodegradables y representan una fuente renovable de compuestos químicos que poseen un alto potencial como inhibidores y con esto incrementan la protección por tiempos prolongados de los materiales.
Referencias
[1]http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/09/htm/masallla.htm
[2] Revie R. W. y Uhlig H. H.(2008). Corrosion and Corrosion Control – An Introduction to Corrosion Science and Engineering. Wiley & Sons, Inc: USA.
[3] https://www.redalyc.org/pdf/4455/445543776001.pdf
[4]https://www.eufic.org/es/que-contienen-los-alimentos/articulo/la-importancia-de-los-acidos-grasos-omega-3-y-omega-6/
[5] https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0212-16112013000100002#:~:text=Se%20encuentra%20en%20la%20naturaleza,son%20conjugados%2C%20por%20lo%20que
[6]https://cideteq.repositorioinstitucional.mx/jspui/bitstream/1021/46/1/Determinaci%C3%B3n%20del%20mecanismo%20de%20deposici%C3%B3n%20de%20pel%C3%ADculas%20de%20samario%20como%20inhibidor%20de%20corrosi%C3%B3n%20en%20soluciones%20acuosas..pdf http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2224-61852012000200001
[7] http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0255-69522012000100012
Fuente: acmor.org