Se abre un universo nuevo: una técnica de microscopia consigue ver átomos individuales
La microscopia crioelectrónica rompe una barrera clave, gracias a lo cual se podrá explorar la actividad de las proteínas con un detalle sin precedentes
La criomicroscopia de electrones, una técnica de creación de imágenes que ha supuesto un cambio radical, acaba de producir las más detalladas que haya ofrecido hasta ahora: en ellas se disciernen individualmente los átomos de una proteína.
Gracias a haber logrado la resolución atómica por medio de la criomicroscopía electrónica (crio-ME), los investigadores van a poder conocer con una precisión sin precedentes el funcionamiento de proteínas que no se pueden examinar con facilidad por medio de otras técnicas de creación de imágenes, como la cristalografía de rayos X.
Este logro, del que informaron dos laboratorios a finales de mayo, consolida la posición de la crio-ME como herramienta dominante en el cartografiado de las conformaciones tridimensionales de las proteínas, dicen los científicos. En última instancia, estas estructuras les valdrán a los investigadores para averiguar cómo actúan las proteínas en la enfermedad y en la salud, y poder así encontrar mejores fármacos con menos efectos secundarios.
“Es un verdadero hito, no cabe la menor duda. Ya no queda nada que romper. Para la resolución, era la última barrera “, dice Holger Stark, bioquímico y microscopista electrónico del Instituto Max Planck de Química Biofísica, en Gotinga, Alemania; dirigió uno de los estudios. El otro lo dirigieron Sjors Scheres y Radu Aricescu, biólogos estructurales del Laboratorio de Biología Molecular del Consejo de Investigación Médica (MRC-LMB), en Cambridge, Reino Unido. Uno y otro artículos se prepublicaron en el servidor bioRxiv el día 22 de mayo.
“La ‘resolución atómica’ de verdad es un auténtico hito”, añade John Rubinstein, biólogo estructural de la Universidad de Toronto, en Canadá. “Obtener estructuras con resolución atómica de muchas proteínas segurá siendo una tarea que arredra porque hay otras dificultades, como la flexibilidad de la proteína”, dice también.
Romper fronteras
Crio-ME es una técnica que existe desde hace décadas. Para determinar la forma de muestras congeladas súbitamente, les dispara electrones y graba las imágenes resultantes. Los avances que han conocido la detección de los electrones que rebotan en la muestra y los programas de análisis de imágenes catalizaron una “revolución de la resolución” que empezó hacia 2013. Con esta, se lograron estructuras de proteínas más nítidas que nunca, casi tan buenas como las obtenidas con la cristalografía de rayos X, una técnica más antigua que infiere las estructuras a partir de los patrones de difracción que crean los cristales de proteínas cuando se las bombardea con rayos X.
Posteriores avances del equipamiento y de la programación condujeron a nuevas mejoras en la resolución de las estructuras obtenidas por crio-ME. Pero los científicos tenían que depender en muy buena medida de la cristalografía de rayos X para obtener imágenes con resolución atómica. Sin embargo, para cristalizar una proteína puede que necesiten meses o años; además, muchas proteínas importantes en medicina no forman cristales que se puedan usar. La crio-ME, por el contrario, requiere solo que la proteína esté en una solución purificada.
Los mapas de resolución atómica tienen la precisión suficiente para discernir inequívocamente la posición de los átomos individuales de una proteína con una resolución de alrededor de 1,2 ångströms (1,2 x 10-10 metros). Estas estructuras resultan especialmente útiles para saber cómo funcionan las enzimas y utilizar esa sabiduría en la busca de fármacos que bloqueen la actividad de aquellas.
Para aumentar la resolución de la crio-EM, los dos equipos trabajaron con una proteína, la apoferritina. Su estabilidad es pétrea; por eso ha servido de campo de pruebas de la crio-EM. El récord de resolución anterior era de 1,54 ångströms.
Los equipos emplearon entonces unas mejoras tecnológicas para tomar imágenes de la apoferritina. El equipo de Stark obtuvo una estructura de la proteína con resolución de 1,25 ångströms; se valió de un instrumento que hace que los electrones viajen a velocidades parecidas antes de golpear la muestra, con lo que se aumenta la resolución de las imágenes resultantes. Scheres, Aricescu y su grupo usaron una tecnología diferente para disparar los electrones a velocidades parecidas. Sacaron provecho además de una tecnología que reduce el ruido generado cuando algunos electrones salen despedidos sin control desde la muestra de proteína; también les vino bien una cámara más sensible para la detección de electrones. Su estructura con resolución de 1,2 ångströms es tan completa, dice Scheres, que pudieron hacer que resaltasen átomos sueltos, tanto en la proteína como en las moléculas de agua circundantes.
Stark calcula que fusionando las tecnologías se podrá llegar a resoluciones de alrededor de 1 ångström, pero no mucho más. “A la crio-EM le es casi imposible llegar por debajo de 1 ångström”, dice. Obtener una estructura con tal resolución con la tecnología actual llevaría “varios cientos de años de grabación de datos y requeriría una potencia de computación y una capacidad de almacenamiento de datos que no son realistas”, según calcula su equipo.
Ver claramente
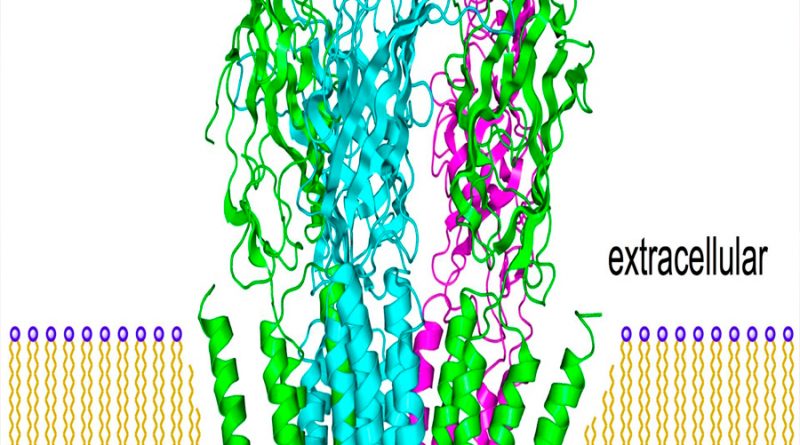
Scheres y Aricescu probaron también sus mejoras con una forma simplificada de proteína, el llamado receptor GABAA. La proteína se encuentra en la membrana de las neuronas y le sirve de blanco a la anestesia general, a los ansiolíticos y a muchos otros fármacos. El año pasado, el equipo de Aricescu empleó la crio-ME para cartografiarla con una resolución de 2,5 ångströms. Pero con los nuevos aparatos obtuvieron una resolución de 1,7 ångströms, e incluso más en algunas partes clave de la proteína. “Fue como quitarse una venda de los ojos”, dice Aricescu. “Con esa resolución, cada medio ångström abre un universo entero”.
La estructura reveló detalles nunca antes vistos en la proteína, entre ellos las moléculas de agua del embolsamiento donde se encuentra la sustancia química histamina. “Es una mina de oro para el diseño de fármacos basado en estructuras”, afirma Aricescu, ya que muestra la forma en que un fármaco puede desplazar a las moléculas de agua, con el posible resultado de que se obtengan medicinas con menos efectos secundarios.
Un mapa con resolución atómica de GABAA, que no es tan estable como la apoferritina, presenta muchas dificultades, dice Scheres. “No creo que sea imposible, pero sí muy poco práctico”: habría que recoger una enorme cantidad de datos. Pero otras mejoras, en particular en la preparación de las muestras de proteína, podrían preparar el terreno para las estructuras con resolución atómica de GABAA y otras proteínas importantes biomédicamente. Las soluciones de proteínas se congelan en pequeñas rejillas de oro; con modificaciones, esas rejillas podrían mantener a las proteínas aún más quietas.
“A todo el mundo le ha emocionado y asombrado hasta dónde han llegado los grupos del MRC-LMB y del Max Planck”, afirma Radostin Danev, especialista en crio-ME de la Universidad de Tokio. Pero coincide en que la preparación de la muestra es la mayor dificultad a que se enfrenta la especialidad cuando se las ve con moléculas más inestables. “Lograr resoluciones por debajo de los 1,5 ångströms, o incluso de los 2, seguirá siendo durante mucho tiempo accesible solo para muestras con buen comportamiento”, asegura.
Los avances seguramente consolidarán la posición de la crio-ME como la herramienta de la que echar mano en la mayor parte de los estudios estructurales, dice Scheres. Las compañías farmacéuticas, que ansían las resoluciones atómicas, podrían estar aún más dispuestas a pasarse a la crio-ME. Pero Stark cree que la cristalografía de rayos X conservará parte de su atractivo. Cuando una proteína se puede cristalizar, aunque este es un señor “cuando”, la cristalografía resulta relativamente eficiente en la generación en un corto plazo de tiempo de estructuras de la proteína para miles de fármacos posibles. Pero generar los datos suficientes para unas estructuras conseguidas con crio-ME con una resolución altísima lleva todavía unas horas o unos días.
“Cada una de estas técnicas tiene aún sus pros y sus contras”, dice Stark. “Se han publicado montones de artículos y repasos que dicen que estos últimos avances de la crio-ME van a ser el aviso de la muerte de los rayos X. Lo dudo”.
Fuente: investigacionyciencia.es