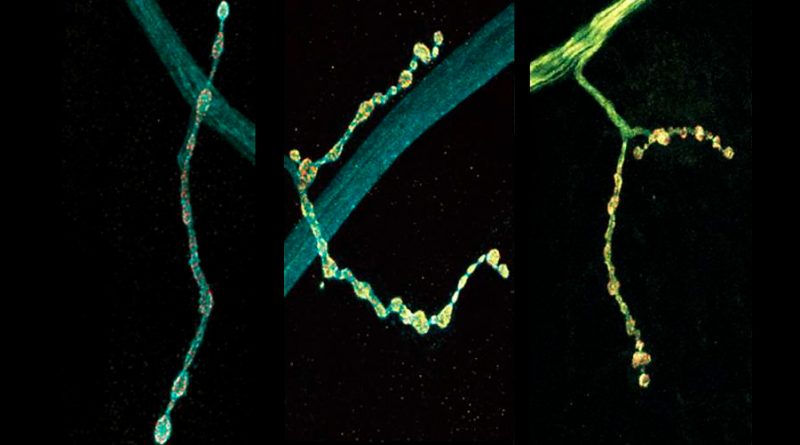
Las neuronas individuales mezclan múltiples ediciones de ARN de la proteína sinapsis clave: estudio en mosca
Las neuronas son conversadoras. Cada uno de ellos se comunica con otras neuronas, músculos u otras células mediante la liberación de sustancias químicas neurotransmisoras en las uniones de “sinapsis”, lo que en última instancia produce funciones que van desde emociones hasta movimientos. Pero incluso las neuronas del mismo tipo pueden variar en su estilo conversacional. Un nuevo estudio en Cell Reports realizado por neurobiólogos del Instituto Picower para el Aprendizaje y la Memoria destaca un mecanismo molecular que podría ayudar a explicar la diversidad matizada del discurso neuronal.
Los científicos hicieron sus hallazgos en las neuronas que controlan los músculos de las moscas de la fruta Drosophila. Estas células son modelos en neurociencia porque exhiben muchas propiedades fundamentales comunes a las neuronas de personas y otros animales, incluida la comunicación mediante la liberación del neurotransmisor glutamato.
En el laboratorio de Troy Littleton, profesor Menicon en los Departamentos de Biología y Ciencias Cognitivas y Cerebrales del MIT, que estudia cómo las neuronas regulan este proceso crítico, los investigadores ven con frecuencia que las neuronas individuales varían en sus patrones de liberación. Algunos “hablan” más que otros.
En más de una década de estudios, el laboratorio de Littleton ha demostrado que una proteína llamada Complexina tiene la función de frenar el parloteo espontáneo del glutamato. Controla la fusión de vesículas llenas de glutamato en la membrana sináptica para preservar el suministro del neurotransmisor para cuando la neurona lo necesita por una razón funcional, por ejemplo, para simular el movimiento de un músculo.
Los estudios del laboratorio han identificado dos tipos diferentes de complexina en moscas (los mamíferos tienen cuatro) y han demostrado que la eficacia de sujeción de la rara pero potente forma de empalme 7B está regulada por un proceso molecular llamado fosforilación. No se sabía cómo se regula la versión 7A, mucho más abundante, pero los científicos habían demostrado que el ARN transcrito del ADN que instruye la formación de la proteína a veces es editado en la célula por una enzima llamada ADAR.
En el nuevo estudio del equipo de Littleton, dirigido por la ex estudiante de posgrado Elizabeth Brija, el laboratorio investigó si la edición de ARN de Complexina 7A afecta la forma en que regula la liberación de glutamato. Lo que descubrió fue sorprendente. La edición de ARN de Complexina 7A no solo tiene un impacto significativo en qué tan bien la proteína previene la liberación de glutamato, sino que también esto puede variar ampliamente entre neuronas individuales porque pueden mezclar y combinar estocásticamente hasta ocho ediciones diferentes de la proteína.
Algunas ediciones fueron mucho más comunes que otras en promedio, pero el 96 por ciento de las 200 neuronas que examinó el equipo tenían al menos alguna edición, lo que afectó la estructura de un extremo de la proteína llamado extremo C-terminal. Los experimentos para probar algunas de las consecuencias de esta variación estructural mostraron que diferentes ediciones de Complexin 7A pueden afectar dramáticamente el nivel de corriente eléctrica medible en diferentes sinapsis.
Ese nivel variable de actividad también puede afectar el crecimiento de las sinapsis que las neuronas forman con los músculos. Por lo tanto, la edición de ARN de la proteína podría dotar a cada neurona de finos grados de control de la comunicación.
“Lo que esto ofrece al sistema nervioso es que se puede tomar el mismo transcriptoma y editar alternativamente varias transcripciones de ARN, estas neuronas se comportarán de manera diferente”, dijo Littleton.
Además, el equipo de Littleton y Brija descubrió que otras proteínas clave implicadas en la liberación sináptica de glutamato, como Synapsin y Syx1A, a veces también se editan en niveles bastante diferentes entre la misma población de neuronas. Esto sugiere que otros aspectos de la comunicación sináptica también podrían ser sintonizables.
“Tal mecanismo sería una forma sólida de cambiar múltiples características de la producción neuronal”, escribieron Brija, Littleton y sus colegas.
El equipo rastreó los diferentes niveles de edición extrayendo y secuenciando meticulosamente el ARN de los núcleos y cuerpos celulares de 200 neuronas motoras. El trabajo arrojó un conjunto de datos lo suficientemente rico como para mostrar que cualquiera de los tres nucleótidos de adenosina que codifican dos aminoácidos en el extremo C podría intercambiarse por otro, produciendo ocho ediciones diferentes de la proteína. Una pequeña mayoría de complexina 7A no se editó en la neurona promedio, mientras que las siete versiones editadas compusieron el resto con grados de frecuencia muy variables.
Para investigar las consecuencias funcionales de algunas de las diferentes ediciones, el equipo eliminó Complexin y luego “rescató” moscas agregando versiones sin editar o dos versiones editadas diferentes. Los experimentos mostraron un marcado contraste entre las dos proteínas editadas. Uno, que ocurre con mayor frecuencia, demostró ser una abrazadera menos efectiva que Complexin sin editar, y apenas previene la liberación espontánea de glutamato y los aumentos en la corriente eléctrica.
El otro resultó ser más eficaz para sujetar que la versión no editada, manteniendo un estricto control sobre la liberación de glutamato y la producción sináptica. Y aunque ambas versiones editadas mostraron una tendencia a alejarse de las sinapsis hacia el axón de la neurona, la larga rama que se extiende desde el cuerpo celular, la edición que se sujetó bien impidió cualquier crecimiento excesivo de las sinapsis, mientras que la que se sujetó mal proporcionó sólo una bordillo magro.
Debido a que a menudo hay múltiples ediciones en las neuronas , Brija y el equipo hicieron una serie más de experimentos en los que “rescataron” moscas sin Complexina con una combinación de Complexina sin editar y la edición de sujeción débil. El resultado fue una combinación de los dos: liberación espontánea de glutamato reducida que con solo la edición de sujeción débil. Los hallazgos sugieren que cada edición no solo afina potencialmente la liberación de glutamato , sino que las combinaciones entre ellas pueden actuar de manera combinatoria.
Fuente: medicalxpress.com