Los premios Nobel de Medicina 2018: Los frenos del sistema inmune y su aplicación en el tratamiento del cáncer
Jesús Martínez Barnetche
El Dr. Jesús Martínez Barnetche es investigador en Ciencias Médicas E y director de área de Infecciones Crónicas y Cáncer, del Centro de Investigación Sobre Enfermedades Infecciosas del Instituto Nacional de Salud Pública. Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
 Continuando con la serie de ganadores del premio Nobel de este año, el galardón en el área de Medicina y Fisiología fue otorgado a James Allison y a Tasuku Honjo por sus contribuciones al entendimiento de la respuesta inmune y como su manipulación mejora el tratamiento de varios tipos de cáncer. Como se explica en la publicación anterior (http://www.acmor.org.mx/?q=content/los-premios-nobel-de-qu%C3%ADmica-2018-la-ingenier%C3%ADa-de-prote%C3%ADnas-en-un-tubo-de-ensayo) es posible utilizar anticuerpos producidos en el laboratorio, para realizar tratamientos contra algunos tipos de cáncer. Sin embargo, no es el único mecanismo para poder elaborar nuevos tratamientos contra el cáncer.
Continuando con la serie de ganadores del premio Nobel de este año, el galardón en el área de Medicina y Fisiología fue otorgado a James Allison y a Tasuku Honjo por sus contribuciones al entendimiento de la respuesta inmune y como su manipulación mejora el tratamiento de varios tipos de cáncer. Como se explica en la publicación anterior (http://www.acmor.org.mx/?q=content/los-premios-nobel-de-qu%C3%ADmica-2018-la-ingenier%C3%ADa-de-prote%C3%ADnas-en-un-tubo-de-ensayo) es posible utilizar anticuerpos producidos en el laboratorio, para realizar tratamientos contra algunos tipos de cáncer. Sin embargo, no es el único mecanismo para poder elaborar nuevos tratamientos contra el cáncer.
Cuando pensamos en el sistema inmune, por lo general pensamos en las defensas que tiene nuestro organismo contra agentes infecciosos (virus, bacterias y parásitos). También sabemos que en el sistema inmune recae la capacidad de las vacunas de protegernos ante la infección correspondiente. No es raro que extendamos erróneamente el concepto de inmunidad a aquella propiedad del organismo que nos protege de cualquier insulto, por ejemplo, un contaminante ambiental. Hasta hace algunos años, el papel del sistema inmune en el control y progresión del cáncer, aunque pueda ser obvio para muchos, ha sido motivo de intenso debate en los círculos académicos más selectos del área de inmunología.
¿Cómo funciona el sistema inmune?
El funcionamiento del sistema inmune, como todos los sistemas vivientes se basa en la recepción de ciertos estímulos, su interpretación a nivel bioquímico y celular, la emisión de una respuesta y finalmente la terminación de la misma. Los estímulos del sistema inmune se denominan antígenos, y son por lo general macromoléculas como proteínas y otras biomoléculas. Los antígenos pueden derivar de los microorganismos, y las células del sistema inmune reconocen a través de proteínas denominadas “receptores de antígeno”. Este reconocimiento se traduce en el interior de la célula en señales bioquímicas de activación (interpretación), que coordinan una respuesta celular, usualmente muy compleja que conocemos como “respuesta inmune” o “defensas”, y cuyo efecto suele ser la eliminación del microorganismo inductor de la respuesta. Una vez que esto sucede, es necesario terminar con la respuesta inmune para dar lugar al retorno de la homeostasis. La homeostasis a grandes rasgos, el balance que se mantiene en las células o en el organismo y que podemos relacionar con un estado de salud.
El paradigma del reconocimiento de lo “propio” y lo “no propio”
Desde los inicios de la inmunología como disciplina, el mecanismo de reconocimiento de estímulos inmunológicos despertó mucho interés. Si asumimos que todas las formas vivientes se construyen a partir de los mismos bloques bioquímicos ¿Cómo es que sistema inmune discrimina entre lo propio y lo extraño? Y una vez que se entendió que el rechazo a trasplantes alogénicos estaba mediado inmunológicamente ¿Cómo el sistema inmune puede reconocer como extraño un tejido proveniente de un individuo que genéticamente es 99% idéntico?
Fue gracias al trabajo de grandes inmunólogos como N Jerne, MF Burnet, P. Medawar y posteriormente S. Tonegawa que se demostró que la exquisita capacidad de reconocimiento y discriminación estructural del sistema inmune se basa en la existencia de un vasto número de receptores de antígeno con especificidad única, cada uno expresado en la superficie de cada linfocito, que es un tipo de célula especializada del sistema inmune y que se encuentra en la sangre. La diversidad potencial de este repertorio se estima en 1 x 1011 (cien mil millones), gracias a lo cual los linfocitos en conjunto pueden reconocer y ejecutar una respuesta inmune contra cualquier estructura tanto propia como extraña. Basándose en los principios de la selección Darwiniana, Burnet propuso que un determinado antígeno selecciona aquellos linfocitos cuyo receptor de antígeno tienen la capacidad de reconocerlo (selección clonal). Cuando el antígeno corresponde a un patógeno, los linfocitos específicos se activan, proliferan y emiten una respuesta inmune (selección positiva). Cuando el antígeno corresponde a una estructura propia, los linfocitos autoespecíficos son eliminados mediante un proceso de suicidio celular denominado apoptosis, manteniendo así la tolerancia a lo propio (selección negativa) (Figura 1) y como se explica en la referencia [1].
Fue así como la idea de la discriminación entre lo propio y lo no propio se convirtió en el dogma prevalente hasta los años 80’s. El modelo era consistente con las enfermedades infecciosas, con las enfermedades autoinmunes como resultado de una “falla” en los mecanismos de selección clonal, y también era consistente con el rechazo a trasplantes alogénicos. Sin embargo, el cáncer es una enfermedad que surge de las propias células del individuo, en muchas ocasiones sin la necesidad de un agente extraño asociado. Por lo tanto, es propio, y de acuerdo al modelo prevalente el sistema inmune no tendría forma de identificarlo como extraño. Por lo tanto, se estableció el dogma de que la respuesta inmune contra tumores, al menos aquellos no asociados a agentes infecciosos, no existía.
Cambio de paradigma en el entendimiento del reconocimiento y activación del sistema inmune
En los años 60’s, Bretcher y Cohn observaron que si un antígeno extraño se administraba en forma soluble y altamente purificado no había respuesta inmune, por el contrario, los animales se volvían refractarios o reacios a producir una respuesta por medio de la inmunización convencional mediante el uso de adyuvantes como sucede con las vacunas. La falta de respuesta era específica para el antígeno inductor y la denominaron “parálisis inmunológica”. En todo caso, estos hallazgos sugerían que lo importante para inducir una respuesta inmune especifica no es tanto si el antígeno es “propio” o “no propio”, sino como este es “interpretado” por el sistema inmune. Un antígeno altamente purificado y soluble era interpretado como “propio”, mientras que el mismo antígeno en forma insoluble y mezclado con material agregado y/o compuestos bacterianos como el lipopolisacárido es interpretado como extraño e induce una respuesta inmune.
Fue hasta finales de los años 80’s y principios de los 90’s cuando Jenkins y Schwartz identificaron in vitro que para inducir una respuesta de linfocitos se requería una segunda señal adicional a la del reconocimiento antigénico mediante el receptor de antígeno. Esa segunda señal era proporcionada por células accesorias denominadas macrófagos, era antígeno-inespecífica y solo se presentaba cuando el macrófago era activado por material agregado y compuestos bacterianos. En ausencia de la segunda señal, los linfocitos no se activaban y de manera similar a lo observado in vivo por Bretcher y Cohn, quedaban en un estado refractario a la activación. En los siguientes años se identificó que las moléculas B7-1 (CD80) y B7-2 (CD86) corresponden a la segunda señal que proporcionan los macrófagos activados. Estas interactúan con el receptor CD28 en los linfocitos T que reconocen al antígeno, permitiendo su activación. Aunado a las contribuciones de Janeway, Matzinger y otros, el paradigma cambio reconciliando ambas visiones: Para lograr la tolerancia a lo propio, muchos linfocitos autoespecíficos son eliminados por selección clonal negativa. Sin embargo, aquellos que no son eliminados siguen siendo tolerantes a lo propio, ya que solo reciben la señal del antígeno propio, pero no aquella señal que depende de la activación de los macrófagos por componentes bacterianos [2].
El “Yin Yang” de la respuesta inmune
El modelo de las 2 señales propuesto por Jenkins y Schwartz fue gratamente recibido por la comunidad académica, pero en especial para aquellos escasos y renegados inmunólogos que estaban convencidos de que el cáncer podía inducir respuesta inmune a pesar de ser “propio”. Encajaban perfecto con las observaciones de Coley un siglo atrás, en las que la aplicación de productos bacterianos en tumores malignos inducía su reducción en tamaño. Estos productos bacterianos inducían la producción de segundas señales que hacían que el tumor se volviera inmunogénico. También explicaban la alta prevalencia de tumores malignos en individuos con deficiencias inmunológicas. Incluso algunos canceres que resultan de un proceso infeccioso como el cáncer de hígado por el virus de hepatitis B (VHB) o el cáncer cérvico-uterino causado por el virus del papiloma humano (VPH) no son eliminados por el sistema inmune, a pesar de albergar crónicamente un virus extraño. Algo hacían los tumores de manera natural que evitaba que el sistema inmune los atacara.
James Allison era de aquellos inmunólogos convencidos que el sistema inmune podía ejecutar una respuesta inmune contra tumores. Desde finales de los 70’s proporcionó evidencia de que los tumores eran potencialmente inmunogénicos e hipotetizó sobre el mecanismo por el cual los tumores evaden ser detectados por el sistema inmune. Desempeño una fructífera carrera científica caracterizando las moléculas esenciales que median el reconocimiento de antígeno por parte de los linfocitos T, así como su papel en la activación de la respuesta inmune. Los trabajos de Jenkins y Schwartz fueron particularmente inspiradores, impulsando su interés en la respuesta inmune anti-tumoral. Para entonces se describió un receptor expresado en linfocitos T activados denominado CTLA-4 que se parecía a CD28. El trabajo de su grupo y otros investigadores como Linsley, Bluestone y Sharpe contribuyeron a identificar que, así como la estimulación de CD28 es una segunda señal obligada para la activación de linfocitos T, la señal vía CTLA-4 representaba lo opuesto: Una señal de apagado de la activación. Allison reconoció inmediatamente que, si bien los tumores podrían pasar desapercibidos por el sistema inmune mediante la ausencia de la señal de CD28, existía la posibilidad que los tumores “apagaran” la respuesta a través de CTLA-4. Inoculó ratones con células cancerosas y al cabo de unos días los ratones presentaban un tumor debajo de la piel. Posteriormente inyectó anticuerpos contra CTLA-4 para bloquear su actividad y la respuesta fue dramática: ¡Los ratones se curaban! [3].
En contraste con el estilo relajado y la apariencia de rockanrolero que caracteriza al tejano Jim Allison, Tasuku Honjo es de apariencia sobria y reservada. Por más de 30 años, Honjo ha liderado a un brillante grupo de inmunólogos moleculares de la universidad de Kyoto en Japón, con igualmente grandes aportaciones al conocimiento del funcionamiento del sistema inmune, como el descubrimiento de moléculas que permiten la comunicación entre células del sistema inmune denominadas interleucinas, y de los mediadores moleculares que permiten que el sistema inmune “aprenda” de retos sucesivos con el mismo antígeno y efectúe respuestas más eficaces.
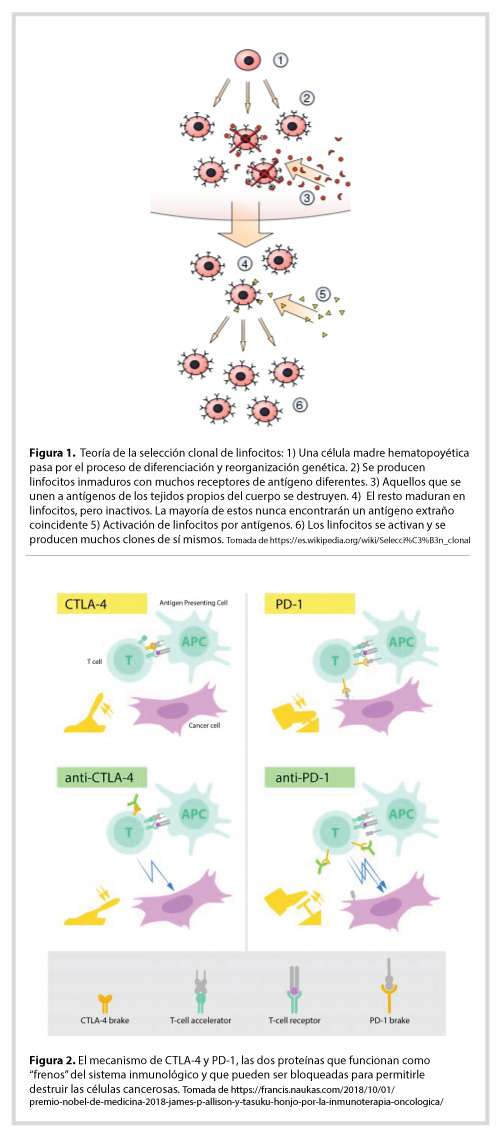
De manera casi simultánea a la historia de CTLA-4, el grupo de Honjo buscaba mediadores que regularan la muerte celular programada (apoptosis) en linfocitos, como mecanismo clave de la tolerancia inmunológica. Encontraron un receptor que denominaron PD-1 (de Programed Death) que se expresaba en la superficie de linfocitos T activados. Los ligandos de PD-1, PD-L1 y PD-L2 fueron identificados algunos años después. Las células cancerosas y las células crónicamente infectadas por ciertos virus expresan PD-L1 y PD-L2, los cuales al interactuar con el receptor PD-1 en linfocitos T activados los “apagan”. De manera similar a CTLA-4, PD-1 es un inhibidor de la actividad de los linfocitos T, y por lo tanto tienen un efecto bloqueador de la respuesta inmune. Honjo demostró que al igual que el bloqueo de la señal de CTLA-4, el bloqueo de la señal de PD-1 en modelos animales de cáncer también limitaba el crecimiento tumoral (Figura 2) [4].
En conjunto, la función de CTLA-4 y PD-1 es terminar la respuesta inmune y prevenir que el sistema inmune se quede continuamente activado, lo cual puede ser perjudicial a la larga. Por eso se les denominó “puntos de control” o “check points”, en inglés [4, 5]. Aunque el “apagado” de la respuesta inmune es necesaria y benéfica en muchos casos, algunos virus y células cancerígenas explotan este sistema de regulación negativa para su propio beneficio: bloquear la actividad del sistema inmune para persistir indefinidamente. En el caso particular del cáncer, la proliferación incontrolada asociado a las mutaciones asociadas a la inestabilidad del genoma canceroso genera nuevos antígenos o “neoantígenos”, a partir de los propios. En ese sentido, dejan de ser “lo propio” para ser extraño. Tan extraño, que en algunos casos “apagan” la activación de los linfocitos T específicos para los neoantígenos tumorales mediante los receptores CTLA-4 y PD-1, de manera que su crecimiento pasa inadvertido al sistema inmune (Figura 2). Allison y Honjo reconocieron que para liberar la actividad anti-tumoral de los linfocitos T de su sometimiento ante el cáncer en humanos, habría que bloquear CTLA-4 o PD-1.
Del ratón a la farmacia
Tanto Allison como Honjo fueron hasta entonces investigadores básicos, comprometidos con la generación de conocimiento y el entendimiento de cómo funciona el sistema inmune. Es posible que hayan tenido la opción de transferir sus descubrimientos a la industria y persistir en su zona de confort académico. Sin embargo, ambos continuaron con la ardua labor de llevar sus observaciones al lado de los pacientes con cáncer. Participaron en la generación de anticuerpos monoclonales humanizados y humanos contra CTLA-4, PD-1 y sus ligandos mediante ingeniería genética. Lidiaron con financiadoras y con la ambición de farmacéuticas transnacionales, para poder probar en pacientes con cáncer refractario a los tratamientos disponibles los potenciales medicamentos nuevos. Los resultados fueron lo suficientemente exitosos en distintos tipos de cáncer, de tal manera que el Ipilimumab (anti-CTLA-4) fue aprobado por la FDA en 2011, mientras que Pembrolizumab y Nivolumab (anti-PD-1) fueron aprobados en 2014. Desde el descubrimiento de CTLA-4 y PD-1 hasta su aprobación por agencias reguladoras sanitarias tuvieron que transcurrir alrededor de 20 años [4, 5].
Sin duda, el Nobel de fisiología y medicina 2018 es bien merecido por Allison y Honjo, por sus enormes contribuciones al entendimiento de cómo se regula el sistema inmune y en particular, por haber llevado el conocimiento a un impacto tangible que esperemos algún día pueda llegar a un sector amplio de la población. Esta historia nos brinda varias enseñanzas: que las intervenciones médicas como la inmunoterapia y la vacunación están científicamente fundamentadas y que antes de cuestionar su eficacia, es necesario profundizar en las complejidades del sistema inmune. Nos enseña que ni el conocimiento, ni los grandes descubrimientos son generados por genios en aislamiento, por lo que siempre habrá debate respecto a los méritos de quien se quedó sin el galardón. Por último, deja claro que la investigación científica y sus frutos requieren de un compromiso académico, empresarial, social y gubernamental sostenido por décadas, no sexenios.
Referencias:
1. https://es.wikipedia.org/wiki/Selecci%C3%B3n_clonal.
2. T cell anergy. RH Schwartz. Sci Am. 1993. 269(2).
3. A conversation with James Allison. J Clin Invest. 2016. doi: 10.1172/JCI84088.
4. Iwai Y, Hamanishi J, Chamoto K, Honjo T. Cancer immunotherapies targeting the PD-1 signaling pathway. J Biomed Sci. 2017. doi: 10.1186/s12929-017-0329-9.
5. https://en.wikipedia.org/wiki/Checkpoint_inhibitor
Fuente: Academia de Ciencias de Morelos