Miguel Enrique Rentería Rodríguez
El Dr. Rentería Rodríguez cursó la Licenciatura en Ciencias Genómicas en la UNAM, campus Morelos; la Maestría en Políticas Públicas en la Universidad de Oxford (Reino Unido); y el Doctorado en Genética Humana en la Universidad de Queensland (Australia). Realizó un posdoctorado en la Escuela de Medicina de Harvard y el Hospital Brigham and Women’s (EE. UU.). Actualmente, es Investigador Titular en el QIMR Berghofer Medical Research Institute en Brisbane, Australia.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
El cerebro es, sin duda, una de las estructuras más fascinantes y complejas del cuerpo humano. Controla nuestras funciones cognitivas, emociones y comportamientos, y no hay dos cerebros idénticos. Cada cerebro es único, moldeado por la genética, el ambiente y las experiencias de vida. Pero ¿cómo se determinan las diferencias estructurales entre los cerebros y qué papel juegan los genes en su desarrollo?
Gracias a los avances en las ciencias genómicas y la tecnología de imágenes cerebrales por resonancia magnética, hemos podido abordar estas preguntas con mayor precisión. En este artículo, comparto con ustedes un emocionante estudio internacional que tuve la fortuna de encabezar, publicado recientemente en la prestigiada revista Nature Genetics(1), donde nuestro trabajo fue destacado en la portada de la edición de noviembre (Fig. 1). En este estudio, combinamos datos de resonancias magnéticas cerebrales y análisis genéticos de un gran número de personas, para identificar variantes genéticas asociadas con el tamaño de diferentes estructuras cerebrales, especialmente en las regiones subcorticales, clave para funciones como la memoria, el control motor y las emociones.

¿Qué es un ‘GWAS’ y por qué es importante?
Antes de adentrarnos en los detalles, es esencial explicar en qué consisten los estudios conocidos como GWAS (Estudio de Asociación del Genoma Completo, por sus siglas en inglés). Imaginemos que queremos encontrar en una biblioteca enorme los libros que explican por qué algunas personas tienen cierta característica, como el color de ojos. En lugar de revisar libro por libro, utilizamos un sistema que nos indica exactamente dónde buscar. En las bibliotecas convencionales, los libros están ordenados por temas, lo que simplifica la búsqueda. Pero en internet, para buscar esa información, tenemos que preguntar por una característica específica y emplear una búsqueda por computadora, filtrando la información para aquellos textos que expliquen el color de ojos, no solo aquellos que hablen sobre color de ojos.
Un GWAS funciona de manera similar: analiza millones de variantes genéticas en miles o incluso cientos de miles de individuos, para identificar aquellas asociadas con un rasgo específico, como el volumen de una estructura cerebral. Estas variantes genéticas son principalmente cambios en una sola base del ADN y por ello se conocen comoSNPs (Polimorfismos de Nucleótido Único, por sus siglas en inglés). Algo importante es que los SNPs son comunes en la población.
Desde el punto de vista estadístico, un GWAS implica realizar pruebas de asociación para cada SNP individualmente. Para cada variante genética, se evalúa si existe una correlación significativa con el rasgo de interés (esto es, si el SNP se presenta con mayor frecuencia en individuos con una característica específica que en individuos de una población en general). Esto se logra mediante modelos estadísticos, como la regresión lineal o logística, que pueden ajustarse por variables de confusión como la edad y el sexo.
Sin embargo, debido a que estamos realizando millones de pruebas estadísticas simultáneamente, surge el problema de las pruebas múltiples. A medida que aumenta el número de pruebas, también lo hace la probabilidad de obtener resultados significativos por puro azar (falsos positivos). Para evitar este problema, aplicamos métodos de corrección estadística que ajustan el umbral de significancia para reducir la probabilidad de falsos positivos, asegurando que los resultados sean verdaderamente significativos.
Esta técnica es poderosa porque nos permite identificar regiones del genoma que influyen en características complejas y multifactoriales. Al descubrir estas asociaciones, podemos entender mejor los mecanismos biológicos subyacentes y, potencialmente, desarrollar nuevas estrategias terapéuticas o preventivas. Por ejemplo, si identificamos variantes genéticas que afectan el volumen de una estructura cerebral asociada con la enfermedad de Alzheimer, podríamos enfocarnos en esos genes para desarrollar tratamientos que retrasen o prevengan la enfermedad.
En resumen, un GWAS es una herramienta estadística y genética que nos ayuda a desentrañar la compleja relación entre nuestro genoma y diversos rasgos o enfermedades. Su importancia radica en su capacidad para analizar grandes cantidades de datos genéticos y descubrir asociaciones que no serían evidentes a simple vista.
El Proyecto y Sus Líderes
El estudio fue dirigido desde Australia por tres investigadores mexicanos. El que escribe, Dr. Miguel Enrique Rentería, soy egresado de la primera generación de la Licenciatura en Ciencias Genómicas (LCG) de la UNAM, formado en Cuernavaca, Morelos. Actualmente soy investigador titular en el Instituto de Investigaciones Médicas “QIMR Berghofer” de Brisbane, Australia.
Trabajé en estrecha colaboración con el Dr. Luis Marco García Marín y el Dr. Adrián Isaac Campos González. El Dr. Campos González, quien es también egresado de la LCG y originario de Morelos, realizó su doctorado bajo mi supervisión y ahora trabaja en la industria farmacéutica en Nueva York. El Dr. García Marín (Fig. 2), es egresado de Ingeniería en Biotecnología del Tecnológico de Monterrey, Campus Guadalajara, y también realizó su doctorado bajo mi tutela; recientemente fue distinguido con el premio AIPS Florey Next Generation Award, otorgado por la Sociedad Australiana de Investigación Médica.
Motivados por entender cómo los genes afectan el desarrollo cerebral y el riesgo de enfermedades, coordinamos este esfuerzo internacional que involucró a 189 investigadores y más de 75,000 participantes de 19 países. Utilizamos imágenes de resonancia magnética de alta resolución para obtener mediciones precisas de las estructuras cerebrales y realizamos análisis genéticos para identificar variantes asociadas con diferencias individuales en el tamaño del cerebro.

Procesamiento de las Imágenes de Resonancia Magnética
La obtención y análisis de las resonancias magnéticas fueron fundamentales en nuestro estudio. Estas imágenes nos permiten ver el cerebro con gran detalle, sin procedimientos invasivos. Recopilamos las resonancias de participantes en diferentes partes del mundo y utilizamos programas especializados para procesarlas.
Primero, alineamos y corregimos las imágenes para asegurar que fueran comparables, sin distorsiones. Luego, aplicamos técnicas que nos permitieron dividir el cerebro en regiones específicas, proceso conocido como parcelación. Esto nos ayudó a medir el volumen de estructuras subcorticales como el hipocampo y la amígdala. Estas mediciones, llamadas fenotipos, fueron esenciales para correlacionarlas con los datos genéticos en nuestro GWAS.
Finalmente, realizamos controles de calidad rigurosos para garantizar la fiabilidad de nuestros datos. Solo así pudimos asegurar que nuestros resultados fueran representativos y útiles para la comunidad científica.
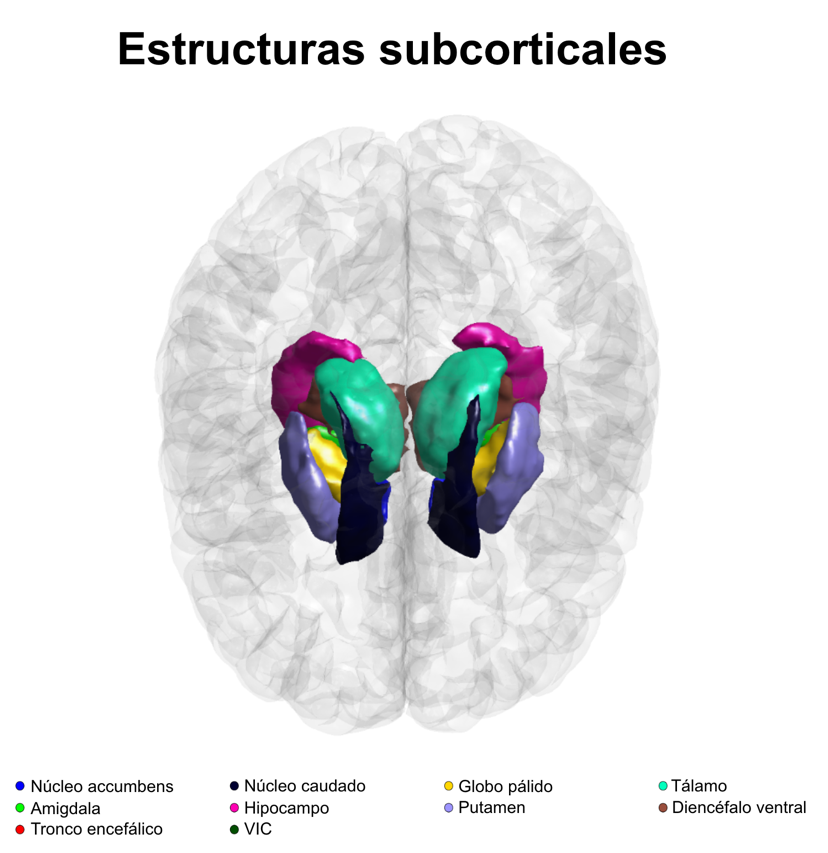
Las Estructuras Subcorticales del Cerebro: Claves en la Memoria y el Movimiento
Las estructuras subcorticales, ubicadas debajo de la corteza cerebral, desempeñan roles cruciales en nuestras funciones diarias. El hipocampo es esencial para la formación de recuerdos; la amígdala regula nuestras emociones, y el tálamo actúa como una estación central que dirige la información obtenida por nuestros al resto del cerebro.
Nuestra investigación se enfocó en estas áreas. Utilizando las resonancias magnéticas procesadas, estimamos el volumen de cada estructura (Fig. 3). La pregunta que nos guiaba era: ¿qué genes influyen en el tamaño de estas regiones y cómo se relaciona esto con el riesgo de desarrollar trastornos neurológicos o psiquiátricos?
Descubrimientos Genéticos: Nuevas Variantes Asociadas con el Volumen Cerebral
Nuestro análisis genético reveló 254 variantes asociadas con el tamaño de las estructuras subcorticales, de las cuales 161 eran desconocidas hasta ahora. Este hallazgo amplía significativamente el conocimiento sobre los factores genéticos que influyen en la anatomía cerebral.
Un descubrimiento notable fue que las variantes que afectan el tamaño del tálamo también están asociadas con enfermedades como el Parkinson y trastornos del sueño como el insomnio. Esto sugiere que ciertos genes no solo influyen en la estructura cerebral, sino que también podrían predisponer a desarrollar ciertas condiciones de salud.
El Papel de CRHR1: Un Gen Clave en la Regulación del Estrés
Entre los genes identificados, uno de los más interesantes fue CRHR1 (receptor de corticotropina), que juega un papel crucial en la regulación del eje hipotálamo-hipófisis-adrenal, un sistema que responde al estrés. Este gen es responsable de coordinar las respuestas hormonales al estrés y también actúa como protector frente a daños moleculares en el cerebro. Los análisis mostraron que CRHR1 se expresa en diferentes momentos del desarrollo cerebral, lo que podría explicar por qué está involucrado en la regulación de varias estructuras subcorticales, como el tálamo y la amígdala.
Estos resultados sugieren que CRHR1 no solo es importante para la respuesta al estrés, sino que también podría desempeñar un papel en la predisposición genética a trastornos psiquiátricos, como la ansiedad y la depresión, que a menudo se desencadenan o agravan por el estrés.
Correlaciones Genéticas con Enfermedades Neuropsiquiátricas
Otro aspecto fascinante fue identificar correlaciones genéticas entre las estructuras cerebrales y diversas condiciones neuropsiquiátricas. Por ejemplo, el Parkinson mostró correlaciones positivas con ocho medidas cerebrales, sugiriendo que ciertas variantes genéticas pueden aumentar el riesgo de desarrollar esta enfermedad.
Por el contrario, el trastorno por déficit de atención e hiperactividad (TDAH) se correlacionó negativamente con tres estructuras cerebrales, indicando que patrones específicos en el desarrollo cerebral podrían asociarse con un mayor riesgo de este trastorno. También observamos que el tamaño total del cerebro está relacionado con características como el peso y la altura al nacer, así como con condiciones como el insomnio.
Cautela en la Interpretación de los Resultados
Es crucial abordar estos hallazgos con prudencia. El hecho de portar una variante genética no significa que una persona desarrollará una enfermedad o condición específica. Las variantes pueden aumentar o disminuir el riesgo en grados variables dependiendo de la variante, pero no son determinantes absolutos.
La genética es solo una pieza del rompecabezas. Factores como el ambiente, el estilo de vida y las experiencias personales también juegan roles fundamentales. Por ejemplo, alguien puede tener variantes asociadas con insomnio, pero hábitos saludables de sueño y manejo del estrés pueden mitigar este riesgo.
Es esencial entender que las probabilidades y riesgos genéticos no definen nuestro destino. Por ello, cualquier aplicación clínica de estos hallazgos debe manejarse con cuidado y acompañarse de asesoramiento profesional.
Implicaciones Futuras: Un Camino hacia Nuevos Tratamientos
Descubrir nuevas variantes genéticas nos abre puertas para futuras investigaciones y posibles tratamientos. Al entender mejor los mecanismos detrás de estas variantes, podemos desarrollar estrategias más personalizadas y efectivas para abordar trastornos neurológicos y psiquiátricos.
Por ejemplo, si sabemos que variantes en el gen CRHR1 influyen en la respuesta al estrés y en ciertas estructuras cerebrales, podríamos diseñar terapias que modulen su actividad, reduciendo el riesgo de trastornos relacionados con el estrés. Además, con los avances en edición genética, es posible que en el futuro podamos corregir variantes que predisponen a enfermedades como el Parkinson.
El estudio del cerebro desde una perspectiva genómica es solo el inicio de una nueva era en la neurociencia. Aunque aún hay mucho por descubrir, el camino es prometedor. Con herramientas avanzadas como las resonancias magnéticas y los análisis genéticos de última generación, estamos cada vez más cerca de entender en profundidad el cerebro humano y su relación con diversas enfermedades.
Cuando era estudiante universitario en Cuernavaca, jamás habría imaginado que, 15 años después, estaría liderando una investigación de este calibre desde el otro lado del mundo. Sin embargo, las ciencias genómicas me han llevado por un camino extraordinario, permitiéndome explorar fronteras desconocidas y seguir mi pasión por desentrañar los misterios del cerebro humano. He tenido el privilegio de contribuir a formar e inspirar a más científicos mexicanos como los doctores Campos y García Marín, quienes están dejando su propia huella en el campo.
Este tipo de investigaciones no solo nos ayudan a comprender mejor cómo funcionamos, sino que también nos ofrecen una esperanza real para desarrollar mejores tratamientos y, eventualmente, prevenir enfermedades que afectan a millones de personas. En futuras entregas, compartiré con ustedes otros estudios emocionantes en los que mi equipo está trabajando.
Referencia
García-Marín, L.M., Campos, A.I., Diaz-Torres, S. et al. Genomic analysis of intracranial and subcortical brain volumes yields polygenic scores accounting for variation across ancestries. Nature Genetics (2024). https://doi.org/10.1038/s41588-024-01951-z
Fuente: acmor.org

