José Luis Viveros Ceballos
José Luis Viveros Ceballos es Doctor en Ciencias por la Universidad Autónoma del Estado de Morelos (UAEM), con codirección en la Universidad de Zaragoza, España. Ingresó al Centro de Investigaciones Químicas de la UAEM en 2015 y actualmente es Profesor Investigador Titular. Es Investigador Nacional Nivel 2. Sus principales líneas de investigación son: a) el diseño, síntesis y evaluación biológica de compuestos de interés farmacológico, principalmente aminoácidos no naturales, b) la síntesis de lactamas policíclicas quirales como bloques de construcción para la síntesis estereoselectiva de heterociclos nitrogenados de interés en química medicinal y c) el desarrollo de nuevas metodologías sintéticas. Es miembro de la Academia de Ciencias de Morelos.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Nuevas moléculas
Durante las últimas décadas, se ha incrementado la necesidad de descubrir nuevas moléculas con potencial terapéutico que nos permitan hacer frente a la alta prevalencia de patologías crónicas, o bien que contribuyan a disminuir los efectos secundarios indeseables asociados a los medicamentos comúnmente utilizados. De esta manera, se han estudiado diversos péptidos, los cuales han presentado actividades biológicas interesantes como antiartrítica, antifúngica, antihipertensiva, antidiabética, antitumoral, antibiótica, entre otras. Las unidades básicas de los péptidos son los aminoácidos, los cuales son compuestos que presentan un grupo carboxílico (-CO2H) y un grupo amino (-NH2) unidos al mismo átomo de carbono; además, al átomo de carbono central se unen un hidrógeno y otro sustituyente variable representado por R, que determina el tipo de aminoácido y sus propiedades (Figura 1).
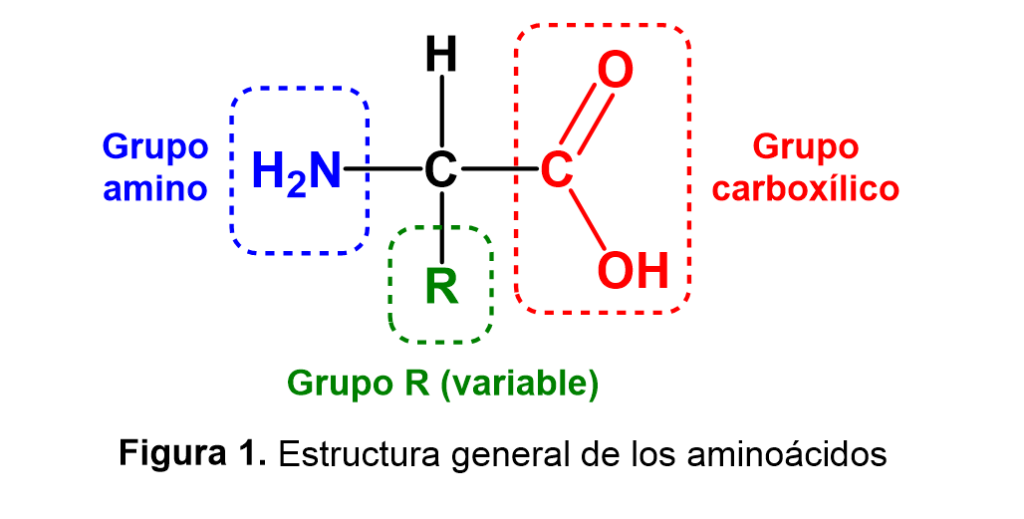
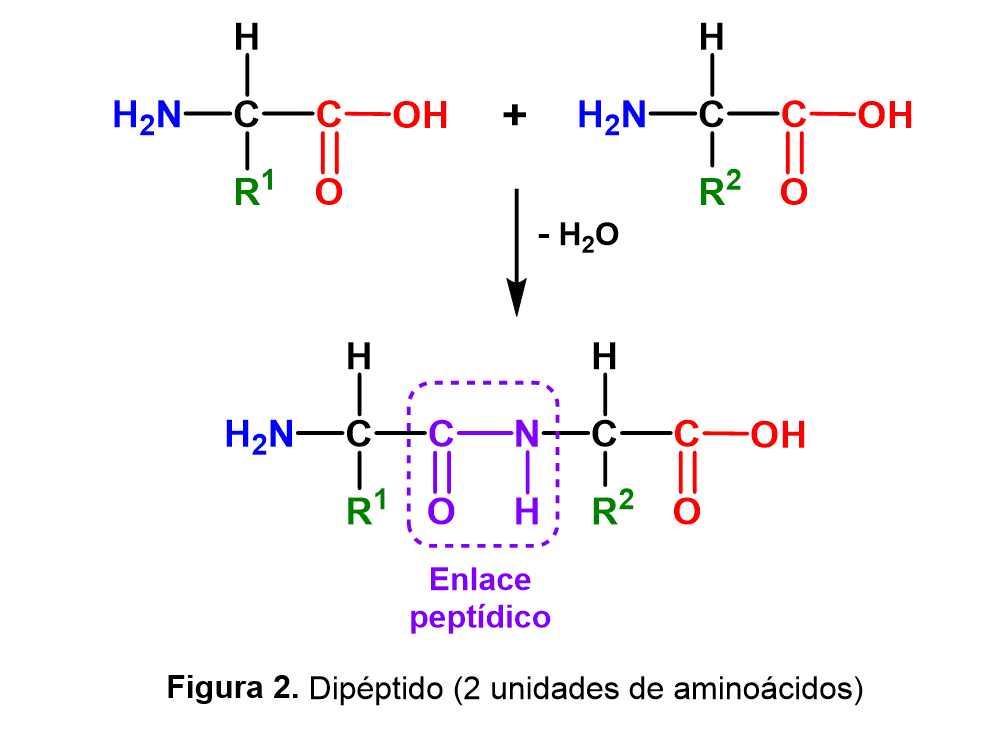
Existen diferentes criterios para clasificar a los aminoácidos, por ejemplo, aquellos que son codificados por el genoma de los seres vivos, se denominan proteinogénicos o naturales y generalmente son 20: alanina, arginina, asparagina, aspartato, cisteína, fenilalanina, glicina, glutamato, glutamina, histidina, isoleucina, leucina, lisina, metionina, prolina, serina, tirosina, treonina, triptófano y valina. Así, los péptidos consisten en cadenas de aminoácidos que se enlazan entre sí a través de enlaces tipo amida (conocido como enlace peptídico), tal como ocurre en las proteínas; sin embargo, la principal diferencia radica en la extensión, ya que un péptido es una cadena corta de aminoácidos (habitualmente de 2 a 50) (Figura 2).
Imitando a la naturaleza
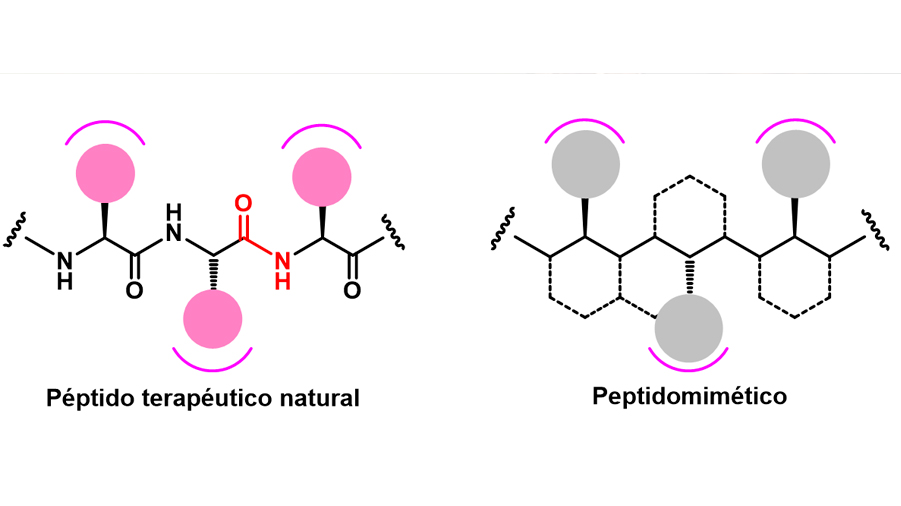
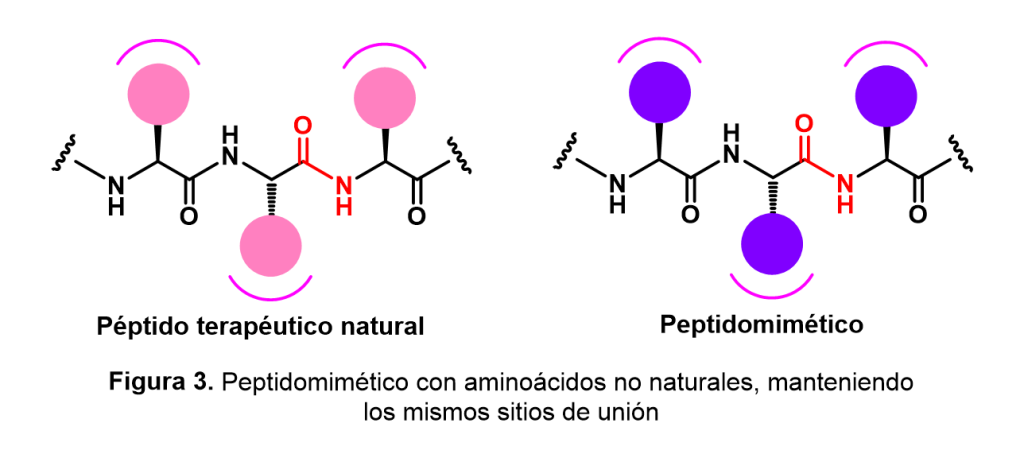
A pesar de que estas moléculas se perfilan como herramientas terapéuticas importantes, en la práctica, hay ciertas consideraciones de selectividad (capacidad para unirse a un sitio determinado con respecto a otros) y estabilidad metabólica (resistencia a la degradación por la acción de enzimas) que han limitado su uso. En este sentido, definimos a un peptidomimético como una estructura diseñada para imitar a un péptido natural, manteniendo las características estructurales que le permiten interactuar con los receptores y/o enzimas, por lo que presentan una actividad biológica similar al péptido de referencia (Figura 3).
Comparados con las moléculas orgánicas pequeñas de interés farmacéutico, los peptidomiméticos generalmente presentan mayor selectividad, resultando en una menor interacción con otros sitios de unión; mientras que, en comparación con las proteínas, los peptidomiméticos exhiben una mayor estabilidad debido a su simplicidad estructural. Además, son más pequeños, por lo que tienen mejor relación actividad terapéutica/masa y mayor permeabilidad (atraviesa las membranas más fácilmente). Otra de las ventajas que presentan, es que los peptidomiméticos pueden ser obtenidos por síntesis química, permitiendo una fácil modificación, a diferencia de las técnicas recombinantes a través de cultivos celulares para la síntesis de proteínas, las cuales generalmente resultan ser más costosas. Todos estos atributos hacen de los peptidomiméticos buenos candidatos para el desarrollo de agentes terapéuticos.
Moléculas con “candados”
Una de las estrategias para la construcción de peptidomiméticos es la restricción conformacional, que consiste en introducir algunas restricciones estructurales específicas para reducir el número total de arreglos posibles que el péptido natural puede adoptar en disolución. De esta manera, dichas restricciones funcionan como “candados” que incrementan la rigidez de la molécula al disminuir su flexibilidad; en consecuencia, se favorece la adopción del arreglo indicado para que la molécula sea reconocida por su receptor biológico. Además, otra de las ventajas de “rigidizar” los péptidos es la obtención de compuestos con mayor biodisponibilidad (cantidad de un fármaco que llega a su sitio de unión) y estabilidad metabólica, factores cruciales para que las nuevas moléculas bioactivas puedan alcanzar la etapa de las pruebas clínicas (Figura 4).
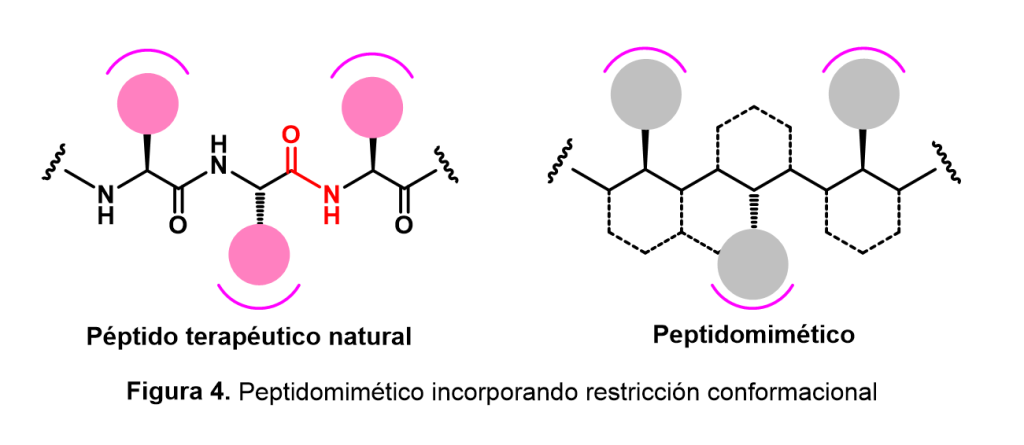
Estas modificaciones implican cambios en la estructura de los péptidos que no ocurren de forma natural, como el reemplazo de diferentes residuos de aminoácidos en el péptido original con aminoácidos no naturales. Éstos se sintetizan de forma artificial y presentan propiedades que no se encuentran en la naturaleza, por lo que un estudio sistemático de la síntesis de aminoácidos no naturales es fundamental para entender el diseño de fármacos por esta vía; además, muchos de estos aminoácidos presentan actividad biológica per se.
Impacto social y medioambiental
En este contexto, el trabajo de investigación que hemos realizado en el grupo tiene un alto impacto social y medioambiental, al enfocarse en el diseño y síntesis de moléculas de interés farmacéutico, así como productos que representan herramientas de gran utilidad en el diseño de nuevos agentes terapéuticos más potentes y seguros, todo lo anterior, implementando procedimientos sintéticos amigables con el medio ambiente. Así, estas líneas de investigación se enmarcan en la síntesis de precursores y moléculas con alto potencial medicinal, un tema de investigación considerado estratégico para el estado de Morelos; así como el Programa Nacional Estratégico de Salud (Pronaces-Salud), promoviendo el desarrollo científico, fortaleciendo la independencia y la soberanía de nuestro país. A continuación, mencionaré ejemplos de nuestras aportaciones en el desarrollo de potenciales agentes terapéuticos, basados en aminoácidos no naturales, para tratar algunas de las principales enfermedades que afectan a la población mexicana.
México es uno de los países con mayor porcentaje de artritis reumatoide, ya que este padecimiento afecta al 1.6% de la población en el país, es decir, más de dos millones de mexicanos lo padecen, y entre el 30 y 40%, presentan incapacidad laboral a los cinco años de diagnóstico, lo que la convierte en una enfermedad discapacitante. Los medicamentos empleados hoy en día para su tratamiento incluyen a analgésicos anti-inflamatorios no esteroidales (AINES), los cuales son útiles debido a su acción anti-inflamatoria y analgésica; sin embargo, debido a la cronicidad del tratamiento, los pacientes presentan con frecuencia problemas gastrointestinales, que incluyen úlceras y/o perforaciones gástricas e incluso sangrados, padecimientos que requieren de cirugías y hospitalizaciones prolongadas. Considerando esta problemática, realizamos la síntesis de una nueva generación de compuestos que demostraron actividad anti-inflamatoria significativa en ensayos biológicos, sugiriendo su potencial para el tratamiento de la artritis reumatoide [1].
Por otra parte, las enfermedades fúngicas invasivas son una de las causas más importantes de mortalidad en pacientes inmunocomprometidos en México, tales como los receptores de trasplantes, pacientes con neoplasias hematológicas, y de manera más reciente, los casos más severos de COVID-19, causados por el virus SARS-Cov-2. Los tratamientos con fármacos como los triazoles y la anfotericina B, se caracterizan por presentar varios efectos secundarios como hepatotoxicidad, neurotoxicidad, nefrotoxicidad, nausea y vómito, por lo que diseñamos una serie de inhibidores enzimáticos como prometedores agentes antifúngicos [2] y desarrollamos una nueva estrategia para abordar la síntesis de su núcleo estructural [3].
La hipertensión arterial se ha mantenido entre las primeras nueve causas de muerte en México, y en los últimos seis años, la tasa de mortalidad por esta causa ha incrementado 29.9%. Anualmente son diagnosticados 544,000 casos nuevos en México y esta cifra podría duplicarse, considerando que hasta el 47.3% de las personas con hipertensión desconocen que padecen esta enfermedad. En la actualidad, los inhibidores de la enzima convertidora de angiotensina (IECA) son considerados fármacos de primera línea en el tratamiento de la hipertensión, siendo el perindopril uno de los ejemplos más destacados. Recientemente, realizamos importantes avances en la preparación de nuevos análogos fosfónicos del perindopril, lo cual podría representar una estrategia valiosa para la generación de nuevos agentes antihipertensivos más potentes y seguros [4].
Es así como los aminoácidos no naturales representan piezas valiosas en la construcción de moléculas que se inspiran e imitan a los péptidos naturales, de la misma manera en que día a día surgen nuevas tecnologías para aplicaciones biomédicas que tienen su origen conceptual en los fenómenos de la naturaleza. Con la adopción de estrategias que combinen estudios teóricos y la experimentación, el desarrollo de nuevos peptidomiméticos más eficientes, podría convertirse en la próxima generación de terapias capaces de hacer frente al problema de las patologías crónicas.
Bibliografía:
- Romero-Estudillo, I.; Viveros-Ceballos, J. L.; Cázares-Carreño, O.; González-Morales, A.; Flores de Jesús, B.; López-Castillo, M.; Razo-Hernández, R. S.; Castañeda-Corral, G.; Ordóñez, M. Synthesis of new α-aminophosphonates: Evaluation as antiinflammatory agents and QSAR studies. Bioorg. Med. Chem. 2019, 27, 2376–2386.
- Marbán-González, A.; Hernández-Mendoza, A.; Ordóñez, M.; Razo-Hernández, R. S.; Viveros-Ceballos, J. L. Discovery of octahydroisoindolone as a caffold for the selective inhibition of chitinase B1 from Aspergillus fumigatus: in silico drug design studies. Molecules 2021, 26, 7606.
- Marbán-González, A.; Maravilla-Moreno, G.; Vazquez-Chavez, J.; Hernández-Rodríguez, M.; Razo-Hernández, R. S.; Ordóñez, M.; Viveros-Ceballos, J. L. Stereocontrolled synthesis of enantiopure cis-fused octahydroisoindolones via chiral oxazoloisoindolone lactams. J. Org. Chem. 2021, 86, 16361–16368.
- Viveros-Ceballos, J. L.; Martínez-Toto, E. I.; Eustaquio-Armenta, C.; Cativiela, C.; Ordóñez, M. First and Highly Diastereoselective Synthesis of Octahydroindole-2-phosphonic acid. Eur. J. Org. Chem. 2017, 6781–6787.
Fuente: acmor.org