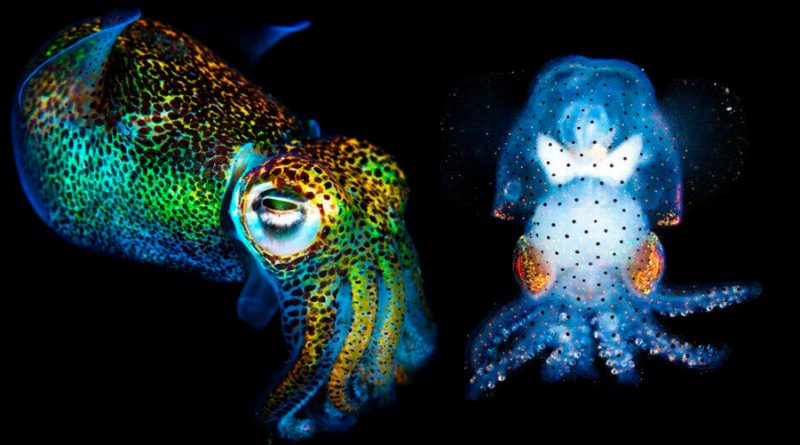
El ‘frankenstein’ genético que permite ver sus tripas mientras está vivo
Un equipo de biólogos marinos ha conseguido editar el genoma de un pequeño cefalópodo para hacer su piel transparente y poder estudiar cómo funciona su sistema nervioso
Investigadores del Laboratorio de Biología Marina (MBL) de la Universidad de Chicago, en EEUU, han utilizado la herramienta de ingeniería genética CRISPR para crear un calamar colibrí casi transparente que permite a los científicos ver el funcionamiento del sistema nervioso de un cefalópodo vivo por primera vez.
Los cefalópodos, entre los que se encuentran los calamares, los pulpos o las sepias, tienen un sistema nervioso tan complejo como fascinante. Estos animales son capaces de aprender y recordar complicadas tareas como resolver laberintos, utilizar herramientas o adquirir nuevas habilidades solo mediante la observación de otros individuos. Un estudio reciente del propio MBL ha revelado que incluso pueden editar su propio ARN para aclimatarse a entornos más fríos.
Sin embargo, los científicos no han podido estudiar todavía su biología a fondo, como sí se ha hecho con animales más habituales en los laboratorios como las moscas de la fruta o los ratones. El problema, según el equipo, está en que los investigadores carecen de un organismo modelo que les permita descubrir las bases genéticas de su desarrollo, de su comportamiento y de su evolución.
Pero eso acaba de cambiar. Según explican los investigadores del MBL en un nuevo estudio, publicado recientemente en la revista Current Biology, han encontrado un candidato viable de cefalópodo modelo que además de ser fácil de criar en el laboratorio durante generaciones, permite su modificación genética.
«Los cefalópodos están rodeados de una biología increíblemente interesante, a diferencia de cualquier otro invertebrado», afirma Joshua Rosenthal, científico principal del MBL y coautor de este estudio. «Ahora tenemos un cefalópodo modelo en el que podemos examinar la función biológica con una resolución mucho mayor que antes».
Cómo lo han conseguido
El equipo optó por trabajar con la Euprymna berryi, una sepia diminuta conocida también como calamar bobtail colibrí que suele rondar entre los tres y los cinco centímetros de tamaño. Los investigadores desactivaron los genes de dos enzimas de pigmentación relacionadas con el albinismo mediante la herramienta de edición genética CRISPR-Cas9, consiguiendo así hacer a la sepia casi transparente.
A continuación un equipo de investigadores de la Universidad de Oregón y de la Universidad de Stanford, que también participan en el estudio, examinaron la actividad cerebral de la diminuta sepia albina insertando un tinte fluorescente en su lóbulo óptico que brilla cada vez que detecta calcio. Los científicos proyectaron después una serie de imágenes en una pantalla frente a la sepia para activar su lóbulo óptico e iluminar el tinte y capturaron imágenes del proceso gracias a un microscopio. Más tarde repitieron la operación con un E. berryi salvaje sin modificar y observaron como la pigmentación de su piel les impedía ver el tinte.
«La capacidad de comprobar de forma directa y precisa la función de los genes en un cefalópodo modelo es apasionante porque permite estudiar las características que hacen especiales a los cefalópodos y será una herramienta importante para comprender muchos aspectos diferentes de su biología única», afirma Caroline Albertin, investigadora del MBL y coautora del estudio.
A la caza de nuevos tesoros biológicos
Los investigadores descubrieron una nueva faceta de la biología del E. berryi que no se conocía hasta ahora. En experimentos anteriores, el equipo había conseguido hacer semitransparente a otra especie de calamar pequeño, llamado Doryteuthis. con solo desactivar un gen de pigmentación llamado TDO. Sin embargo, al aplicar la misma técnica a las crías de E. berryi el resultado fue que seguían pigmentadas. Esto hizo que el equipo se diera cuenta de que había otro elemento responsable de la pigmentación, una segunda enzima llamada IDO que no se había visto hasta el momento en los cefalópodos. Los biólogos reconocen que son incapaces de explicar por qué es necesario una segunda enzima en este proceso que tiene exactamente las mismas funciones que la primera.
Aun así, el equipo de investigadores con Rosenthal y Albertin a la cabeza, esperan que su descubrimiento sirva, no solo para ampliar el conocimiento sobre el E. berryi, sino también como una herramienta que pueden usar otros científicos para desentrañar los misterios de la biología de los cefalópodos. Rosenthal asegura que el nuevo estudio demuestra que también se pueden realizar otras alteraciones genéticas en los cefalópodos que permitan ampliar las posibilidades de nuevos descubrimientos.
«Queremos que estos animales se compartan con la comunidad investigadora», afirma Rosenthal. «Los cefalópodos contienen tesoros de novedades biológicas. Queremos que la gente los utilice para plantearse preguntas que inviten a la reflexión y llegar a hallazgos novedosos».
Fuente: elconfidencial.com