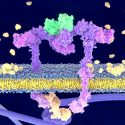
Ingenieros biomoleculares de la Universidad de Washington utilizaron un programa informático para diseñar y crear complejas proteínas transmembranales no encontradas en la naturaleza para realizar tareas específicas.
El estudio, publicado hoy en la revista Science, mostró que los científicos pudieron fabricar las proteínas transmembranales diseñadas dentro de bacterias y células de mamíferos a partir de 215 aminoácidos, los cuales son térmicamente estables y pueden orientarse hacia la membrana.
Peilong Lu y sus colegas utilizaron el programa informático Roseta que puede predecir la estructura en la que se doblará una proteína antes de ser sintetizada.
Las formas de las proteínas dependen de complejas interacciones entre los aminoácidos y entre los aminoácidos y el entorno, pero finalmente alcanza el estado de menor energía posible. El programa puede mostrar la estructura con el menor estado de energía de entre decenas de miles de estructuras modelo.
Pero el verdadero desafío es que parte de las proteínas transmembranales deben atravesar el interior de la membrana compuesta por lípidos.
Las proteínas transmembranales que actúan mientras están incrustadas dentro de la membrana celular son más difíciles de estudiar que las proteínas que operan en la solución acuosa que compone el citoplasma de la célula o en el fluido extracelular.
En fluidos acuosos, los residuos de los aminoácidos polares o no polares pueden separarse dado que los polares «quieren el agua» y los no polares «temen el agua», de modo que los polares se ubican en la superficie de las proteínas, en donde interactúan con el agua, y los no polares se encuentran dentro del núcleo de la proteína, lejos de los fluidos acuosos.
La proteína que se pliega en las membranas es complicada porque el lípido interior de la membrana es no polar, por lo que no se separan las cargas eléctricas. De tal forma, una proteína estable debe colocar los residuos no polares en su superficie y guardar los polares dentro, justo al contrario que en fluidos acuosos.
El equipo de Lu logró diseñar proteínas en las que los residuos polares se ajustan de tal manera que forman interacciones polares que pueden atar a la proteína desde adentro.
Al igual que en las proteínas transmembranales naturales, las proteínas diseñadas pueden atravesar la membrana varias veces y ensamblarse en complejas proteínas múltiples y estables, como dímeros, trímeros y tetrámeros.
De acuerdo con los investigadores, muchas proteínas transmembranales actúan como puertas para el movimiento de sustancias específicas a través de la membrana biológica y algunas reciben o transmiten señales de las células, de modo que muchos medicamentos están diseñados para dirigirse a proteínas transmembranales y modificar sus funciones.
Fuente: Xinhua