La malaria afecta a cientos de millones de personas en todo el mundo y mata a más de 400.000 al año, según la Organización Mundial de la Salud. Las décadas de uso de insecticidas no han logrado controlar los mosquitos que transportan el parásito de la malaria y han dado lugar a una resistencia a los insecticidas entre muchas cepas de mosquitos. Los científicos han comenzado a modificar genéticamente los mosquitos y otros organismos que pueden ayudar a erradicarlos, pero ninguno de estos enfoques transgénicos superó las pruebas de laboratorio.
En un artículo de investigación publicado en la edición de este viernes de la revista ‘Science’, un equipo de científicos de la Universidad de Maryland, Estados Unidos, y Burkina Faso describe el primer ensayo fuera del laboratorio de un enfoque transgénico para combatir la malaria. El estudio demostró que un hongo natural creado para administrar una toxina a los mosquitos redujo de forma segura las poblaciones de mosquitos en más de un 99 por ciento en un entorno de pueblo simulado, cerrado por una pantalla, en Burkina Faso, en África Occidental.
«Ningún control de la malaria transgénica ha llegado tan lejos en el camino hacia las pruebas de campo reales», subraya el autor principal del artículo, Brian Lovett, estudiante graduado en el Departamento de Entomología de la UMD. «Este documento marca un gran paso y sienta un precedente para que este y otros métodos transgénicos avancen». «Demostramos que la eficacia de los hongos transgénicos es mucho mejor que el tipo salvaje que justifica el desarrollo continuo», añade el coautor del estudio Raymond St. Leger, distinguido profesor universitario de Entomología en la UMD.
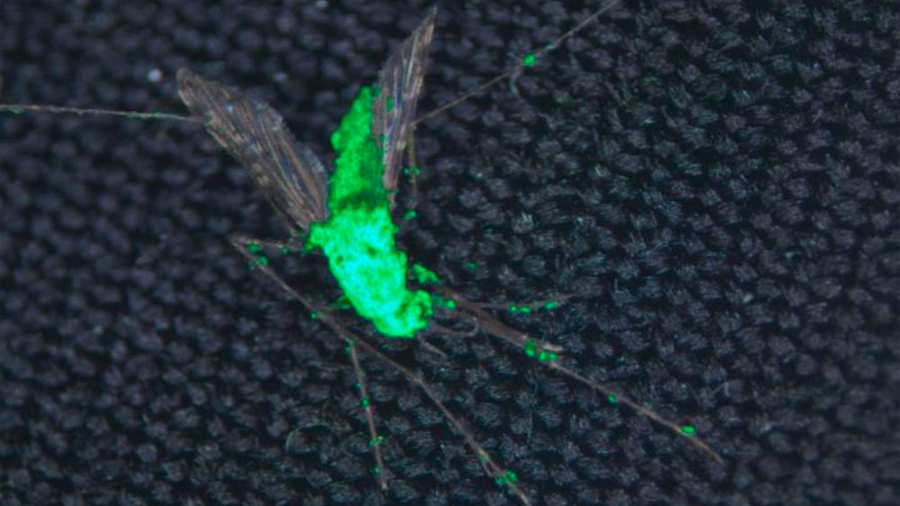
El hongo es un patógeno natural que infecta insectos en la naturaleza y los mata lentamente. Se ha utilizado para controlar diversas plagas durante siglos. Los científicos utilizaron una cepa del hongo que es específica para los mosquitos y la diseñaron para producir una toxina que mata a los mosquitos más rápidamente de lo que pueden reproducirse. Este hongo transgénico hizo que las poblaciones de mosquitos en su sitio de prueba colapsaran a niveles insostenibles dentro de dos generaciones.
Posible infección de la población de mosquitos portadores de la malaria
«Se puede pensar que el hongo es una aguja hipodérmica que usamos para administrar una potente toxina específica para insectos en el mosquito», pone como ejemplo St. Leger. La toxina es un insecticida llamado ‘Hybrid’. Se deriva del veneno de la araña de tela de embudo de las Montañas Azules de Australia y ha sido aprobado por la Agencia de Protección Ambiental (EPA, por sus siglas en inglés) para su aplicación directamente en cultivos para controlar plagas de insectos agrícolas.
«La simple aplicación de los hongos transgénicos a una sábana que colgamos en una pared en nuestra área de estudio provocó que las poblaciones de mosquitos colapsaran en 45 días –resalta Lovett–. Y es tan eficaz para matar mosquitos resistentes a los insecticidas como los no resistentes».
Lovett cree que las pruebas de laboratorio sugieren que el hongo infectará la gama de mosquitos portadores de malaria. La abundancia de especies que transmiten la malaria ha obstaculizado los esfuerzos para controlar la enfermedad, porque no todas las especies responden a los mismos métodos de tratamiento.
Para modificar el hongo ‘Metarhizium pingshaense’ de modo que produzca y distribuya ‘Hybrid’, el equipo de investigación de la Universidad de Maryland utilizó un método estándar que emplea una bacteria para transferir intencionalmente el ADN a los hongos. El ADN que los científicos diseñaron e introdujeron en los hongos proporcionó los planos para crear ‘Hybrid’ junto con un interruptor de control que le dice al hongo cuándo debe fabricar la toxina.
El interruptor de control es una copia del propio código de ADN del hongo. Su función normal es decirle al hongo cuándo debe construirse una capa protectora alrededor de sí mismo para que pueda esconderse del sistema inmunológico de un insecto. Construir esa cáscara es costoso para el hongo, por lo que solo hace el esfuerzo cuando detecta el entorno adecuado, dentro del torrente sanguíneo de un mosquito.
Al combinar el código genético para ese interruptor con el código para hacer híbrido, los científicos pudieron asegurarse de que su hongo modificado solo produce la toxina dentro del cuerpo de un mosquito. Estos expertos probaron su hongo modificado en otros insectos en Maryland y Burkina Faso, y encontraron que el hongo no era dañino para especies beneficiosas como las abejas.
«Estos hongos son muy selectivos –destaca St. Leger–. Saben dónde están a partir de las señales químicas y las formas de las características en el cuerpo de un insecto. La cepa con la que trabajamos es como los mosquitos. Cuando este hongo detecta que está en un mosquito, penetra en la cutícula del mosquito y entra al insecto, pero no causará problemas a otros insectos, por lo que es bastante seguro para especies beneficiosas como las abejas».
Tras demostrar la seguridad de sus hongos genéticamente modificados en el laboratorio, Lovett y St. Leger trabajaron estrechamente con colegas científicos y autoridades gubernamentales en Burkina Faso para probarlo en un ambiente controlado que simulaba la naturaleza. En un área rural, endémica de la malaria en Burkina Faso, construyeron una estructura de unos 608 metros cuadrados, con mosquitero, que llamaron ‘MosquitoSphere’. En el interior, múltiples cámaras protegidas contenían cabañas experimentales, plantas, pequeños charcos de cría de mosquitos y una fuente de alimento para los mosquitos.
Posible aplicación en entornos reales
En una serie de experimentos, los investigadores colgaron una sábana de algodón negro cubierta con aceite de sésamo en la pared de una cabaña en cada una de las tres cámaras. Una sábana recibió aceite mezclado con el hongo transgénico ‘Metarhizium pingshaense’, otra se impregnó de aceite con ‘Metarhizium’ de tipo salvaje y otra recibió solo aceite de sésamo. Luego, liberaron 1.000 mosquitos machos adultos y 500 hembras adultas en cada cámara de ‘MosquitoSphere’ para establecer poblaciones de reproductores. Luego, los autores contaron los mosquitos en cada cámara todos los días durante 45 días.
En la cámara que poseía la sábana tratada con el hongo transgénico, las poblaciones de mosquitos se desplomaron durante 45 días a solo 13 mosquitos adultos. Eso no es suficiente para que los machos creen un enjambre, que se requiere para que los mosquitos se reproduzcan. En comparación, los investigadores contaron 455 mosquitos en la cámara tratados con hongos de tipo salvaje y 1.396 mosquitos en la cámara tratados con aceite de sésamo común después de 45 días. Hicieron este experimento varias veces con los mismos resultados dramáticos.
Según los investigadores, es sumamente importante que las comunidades locales empleen fácilmente nuevas tecnologías contra la malaria, como la probada en este estudio. Las sábanas de algodón negro y el aceite de sésamo son relativamente económicos y están disponibles a nivel local. La práctica tampoco requiere que las personas cambien su comportamiento, ya que se puede el hongo aplicar junto con los pesticidas que se usan comúnmente en la actualidad.
Ahora, el equipo internacional de científicos espera probar sus hongos transgénicos en una comunidad o aldea local. Hay muchos puntos de referencia regulatorios y sociales que deben cumplirse antes de implementar este nuevo método en un entorno abierto como un pueblo, pero los investigadores creen que este estudio ayuda a defender estos ensayos.
Fuente: infosalus.com