Este nuevo enfoque, han explicado los investigadores del Hospital Lahey en Burlington y de la Universidad de Tufts en Medford, ambas en Massachusetts (EEUU), podría algún día ayudar a los médicos a detectar metástasis de cáncer que de otro modo sería difícil de ver a través de tecnologías de imágenes estándar durante las operaciones.
“Las técnicas existentes son invaluables pero sufren de baja resolución espacial y a menudo requieren el uso de agentes de contraste exógenos”, ha señalado Thomas Schnelldorfer del Hospital Lahey, uno de los autores del estudio, junto con Dimitra Pouli de la Universidad de Tufts, quien ha dirigido es la autora principal.
“El método utilizado en este trabajo identifica en un de manera completamente libre de etiquetas, características celulares y tisulares a nivel microscópico, esencialmente actuando como una biopsia sin cuchillo”, ha señalado Pouli.
El estudio, publicado en la revista B’iomedical Optics Express’ de la Sociedad Óptica (OSA), demuestra el uso de microscopía multifotónica junto con algoritmos automatizados de análisis estadístico e imagen para examinar biopsias recién extirpadas de la cavidad peritoneal, una parte del abdomen que con frecuencia se ve afectada por cánceres metastásicos, especialmente para pacientes con cáncer de ovario.
Es la primera vez que el tejido peritoneal humano sano y metastásico se ha evaluado con éxito combinando esta modalidad de microscopía con técnicas de análisis de textura de imagen. Y debido a que el enfoque evalúa las características del tejido celular y extracelular a nivel microscópico, podría identificar metástasis de cáncer en una etapa anterior cuando puede ser más fácil de tratar.
Mediante el uso de algoritmos para clasificar tejidos, el enfoque también podría ayudar a reducir el sesgo en la interpretación de imágenes y complementar los métodos que se basan en la experiencia humana. “En última instancia, esto podría ayudar a los cirujanos a identificar áreas sospechosas o enfermas directamente en la sala de operaciones en tiempo real, lo que a su vez afectaría directamente el manejo del paciente”, ha explicado Schnelldorfer.
“A medida que el método explota las señales tisulares inherentes presentes de manera casi ubicua en los tejidos, puede aplicarse a otros tipos de cáncer y otras aplicaciones, como la fibrosis y la enfermedad cardiovascular, donde la estructura del tejido y la remodelación de la matriz extracelular se ven alteradas por los procesos de la enfermedad subyacente”, ha añadido Irene Georgakoudi, codirectora del estudio de la Universidad de Tufts.
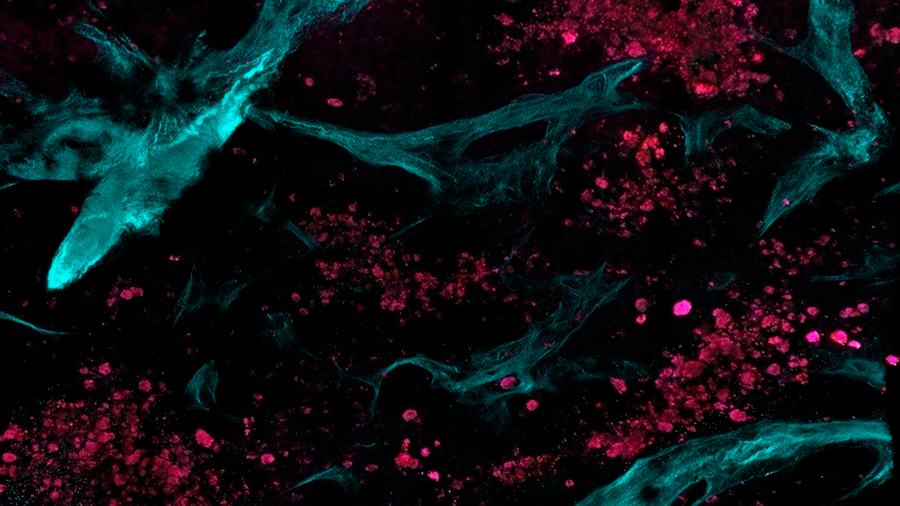
La microscopía multifotónica funciona mediante la entrega de luz láser al tejido. Aunque el láser tiene una intensidad máxima alta, se administra en pulsos muy cortos para mantener la potencia promedio pequeña y no causar daño tisular. A medida que diferentes componentes del tejido interactúan con la luz láser, emiten señales que luego son recuperadas por el microscopio para crear una imagen.
Una vez que se adquieren las imágenes, se pueden usar algoritmos automatizados de procesamiento de imágenes para revelar características de textura únicas. Estas características, que no son visibles en las imágenes adquiridas con las herramientas de imagen operativas estándar, se pueden analizar con modelos estadísticos para clasificar el tejido como sano o enfermo.
Una fortaleza clave del enfoque es que la adquisición y el análisis de imágenes se basan en componentes del tejido en sí, como las células o el colágeno, una proteína que forma el tejido conectivo, en lugar de los tintes de contraste que se le han agregado. Esto permite el análisis de características inherentes relacionadas con la forma y la función de una manera completamente no invasiva y no destructiva.
Los investigadores encontraron que el tejido sano y enfermo mostraba patrones distintivos en términos de contraste (una medida de las diferencias de intensidad de píxel a píxel) y correlación (una medida de la repetición del patrón). Mientras que los tejidos sanos mostraron una mayor variación en estas características, las imágenes de tejido metastásico mostraron patrones de intensidad más uniformes y fibras más pequeñas. Estos cambios reflejan la destrucción del tejido conectivo nativo por las células cancerosas, proporcionando un sello distintivo de la metástasis del cáncer.
Mejorando la estadificación del cáncer
Determinar el alcance y la ubicación de la propagación cancerosa, conocida como estadificación, es crucial para un tratamiento eficaz contra el cáncer. Las imágenes radiográficas transversales y la laparoscopía de luz blanca son herramientas utilizadas para identificar metástasis abdominales, pero a menudo se quedan cortas cuando se trata de detectar lesiones más pequeñas enterradas dentro del tejido sano. Las biopsias y la evaluación microscópica también juegan un papel clave en la determinación de si las células cancerosas han hecho metástasis y han comenzado a invadir el microambiente del tejido.
Cuando el cáncer de ovario comienza a extenderse, con mayor frecuencia aparece primero en el peritoneo, una membrana que recubre la cavidad abdominal. Para probar su nuevo método, los investigadores lo usaron para analizar biopsias peritoneales recolectadas de ocho pacientes con neoplasia ovárica confirmada o sospechada.
Analizando 41 imágenes adquiridas de las biopsias, la técnica clasificó correctamente 40 de 41 imágenes (una precisión del 97.5 por ciento). Un total de 11 muestras se clasificaron correctamente como metastásicas (100 por ciento de sensibilidad) y 29 de 30 se clasificaron correctamente como sanas (96,6 por ciento de especificidad).
Los investigadores planean continuar probando el método en una muestra más grande de imágenes de una población de pacientes más amplia. Si bien el método de análisis se optimizó para detectar el cáncer de ovario que ha hecho metástasis en el tejido peritoneal parietal, la misma técnica podría adaptarse para analizar otros tipos de tejidos y otros tipos de cáncer.
Aunque se usaron biopsias para probar el método, los investigadores dicen que el objetivo final es aplicarlo directamente a las áreas del cuerpo donde se detecta o sospecha cáncer, sin la necesidad de biopsias o tintes.
Antes de que la técnica se pueda utilizar para el análisis de tejidos en tiempo real durante la cirugía, se necesitará trabajo adicional para miniaturizar los componentes de la microscopía, integrar el microscopio con la instrumentación quirúrgica y permitir el análisis en tiempo real de las imágenes adquiridas directamente en la sala de operaciones.
Fuente: EP