El sistema inmunitario constituye la barrera defensiva del organismo frente a los agresores, ya sean externos –como los virus o las bacterias– como internos –caso de las células tumorales–. Tal es así que nuestra salud depende en gran medida de nuestra capacidad inmunitaria para reconocer y combatir estos ‘cuerpos extraños’ nocivos. El problema es que, en ocasiones, la respuesta del sistema inmune es exagerada, tal y como sucede en el asma. Una situación que se agrava más aún cuando las células inmunes atacan a las propias células del organismo y las destruyen, como ocurre en las enfermedades autoinmunes como el lupus. Pero, en los casos que se extralimita en sus funciones, ¿no hay nada que se pueda hacer para frenar este ‘entusiasmo destructor’ del sistema inmune? Pues sí. Como muestra un estudio llevado a cabo por investigadores del Instituto Salk de Estudios Biológicos en La Joya (EU) tan ‘solo’ habría que inhibir una enzima denominada ‘escramblasa 1 de los fosfolípidos’ (PLSCR1).
Como explica Axel Nimmerjahn, director de esta investigación publicada en la revista Neuron, “por lo general, el sistema inmune reconoce y actúa rápidamente frente a una amenaza potencial como son las células infectadas por un virus. Sin embargo, y actuando sobre la PLSCR1, hemos sido capaces de proteger a las células infectadas del ataque inmunitario y de incrementar la expresión de un virus diseñado por ingeniería genética por un periodo de hasta seis meses, creando así el potencial para terapias mucho más duraderas”.
Frenar el instinto destructor
Por lo general, lo primero en lo que pensamos cuando oímos la palabra ‘virus’ es en patógeno, ya sea en el virus de la gripe o en el temido virus de la inmunodeficiencia humana (VIH). Sin embargo, no todos son ‘malos’. Por ejemplo, existen algunos virus que pueden ser empleados por los investigadores con un objetivo terapéutico, como sería corregir las deficiencias en el material genético de las células o destruir las células cancerígenas.
Tras millones de años de evolución, los virus se han especializado en entrar en las células y utilizar su maquinaria molecular para su propio beneficio. Un aspecto que están aprovechando en los últimos años los científicos para manipular estos virus y emplearlos como vectores para transportar material a las células, ya sea un gen –que se insertará en el ADN celular– o un fármaco. Pero terapéuticos o no, no dejan de ser virus, por lo que también serán rastreados y atacados por el sistema inmune. Entonces, ¿cómo evitar que las células inmunitarias no desguacen estos virus ‘sanadores’ y puedan llevar a cabo su beneficio?
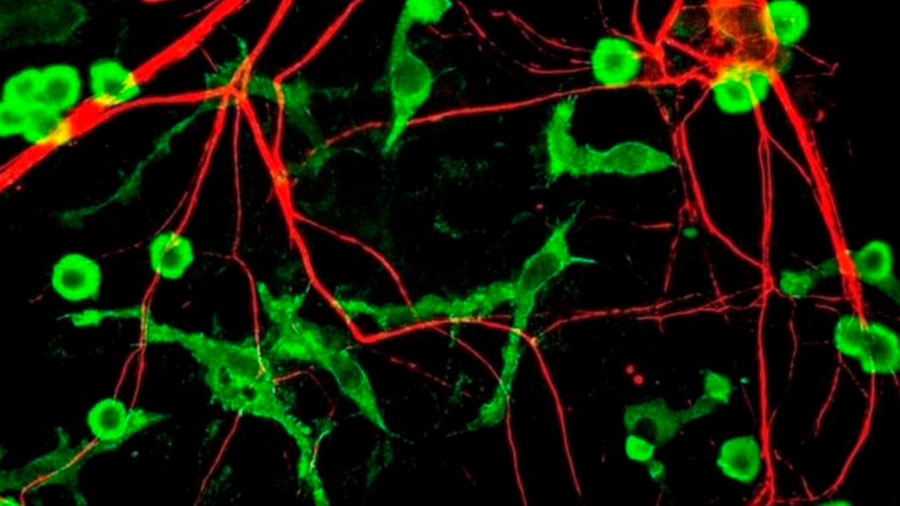
Para responder a esta pregunta, los autores han centrado su investigación en la respuesta inmune en el cerebro. Y para ello, inyectaron un adenovirus manipulado genéticamente en el cerebro de un modelo animal –ratones– para observar las señales emitidas tanto por las células infectadas como por las células inmunes y analizar las proteínas producidas en respuesta a la infección.
Una vez es infectada, la célula emite señales de socorro, caso de la exposición en su membrana externa de un lípido denominado ‘fosfatidilserina’ que atrae a las células inmunes del cerebro –las microglías–. Y, ¿qué sucede a continuación? Pues las microglías evalúan si aislar a la célula infectada –lo que supone un riesgo de expansión de la infección a las células circundantes– o destruirla –lo que puede suponer un problema dado que la función de esta célula cerebral puede ser muy importante y, una vez eliminada, no se regenera–. Así, y con objeto de conocer los pormenores de esta decisión de las microglías, los autores alteraron los niveles de las proteínas implicadas en la comunicación –o ‘señalización’ tanto intra como extracelular.
Los resultados mostraron que la reducción de los niveles de PLSCR1 provocó una gran variedad de cambios en la respuesta inmune: las microglías se mantuvieron a una distancia prudente, pero sin intervenir, y se disminuyó la producción de citoquinas –proteínas que promueven la inflamación, sobre todo al convocar a más células inmunes al combate.
Pero, ¿qué es lo que hace esta PLSCR1? Pues transportar la fosfatidilserina al exterior de la membrana celular –activando la señal de socorro.
Más allá de las infecciones
Es más; los resultados también mostraron que los efectos protectores de la inhibición de PLSCR1 se mantuvieron durante seis meses, el periodo máximo alcanzado hasta el momento con cualquier manipulación de las proteínas implicadas en la respuesta inmune. Un aspecto que resulta muy importante dado que PLSCR1 no es exclusiva del cerebro, sino que se encuentra en todo el organismo. Tal es así que los autores creen que, más allá de facilitar el transporte de tratamientos a través de los virus, los resultados podrían aplicarse a otros trastornos inflamatorios –como las infecciones– e, incluso, a las enfermedades autoinmunes y las patologías neurodegenerativas –caso del alzhéimer.
Como indica Yusuf Tufail, co-autor de la investigación, “cuando vimos que la inhibición de PLSCR1 reducía la respuesta inflamatoria, nos preguntamos si este mecanismo se podría aplicar no solo a los virus que atacan el cerebro, sino también a otros tipos de infecciones e, incluso, a las enfermedades autoinmunes”.
Como concluye Axel Nimmerjahn, “dada la complejidad de la respuesta inmune y del gran número de genes que son activados o silenciados en la respuesta a las infecciones, es realmente asombroso que una única proteína controle tantas rutas biológicas. Solo hay que imaginar la posibilidad de desarrollar un fármaco inhibidor que un paciente podría tomar para frenar el exceso de inflamación, lo que tendría un efecto beneficioso enorme sobre un gran número de enfermedades”.
Fuente: abc.es/salud