Las proteínas son largas cadenas de aminoácidos y son los componentes básicos de todos los seres vivos. Estas cadenas forman complejas estructuras tridimensionales que juegan un papel clave en su función, como cuando encajan unas con otras a modo de llave y candado, por ejemplo.
Así que uno de los grandes retos de la biología molecular consiste en entender cómo las proteínas crean estas formas, y cómo lo hacen de manera tan fiable y rápida. Esto se conoce como el problema del plegamiento de las proteínas.
Este misterio tiene un subargumento interesante. Durante años, los biólogos moleculares sostenían que aunque las proteínas estaban altamente enredadas, en condiciones normales no podían formar nudos porque esto atraparía la estructura y impediría que se siguieran plegando.
Pero con el cambio de siglo apareció una nueva teoría. Los biólogos han descubierto que algunas proteínas sí forman nudos. Y eso genera varias preguntas interesantes: ¿cómo se forman y por qué?
Hoy, recibimos más datos gracias al trabajo de la investigadora de la Universidad de Cambridge (Reino Unido) Sophie Jackson y varios compañeros. El equipo ha estudiado el campo de las proteínas que forman nudos y han definido las principales preguntas que siguen sin respuesta.
Este trabajo tiene un potencial significativo. Las proteínas mal plegadas pueden ser tóxicas, por lo que entender mejor estos nudos y por qué se forman podría tener importantes implicaciones médicas.
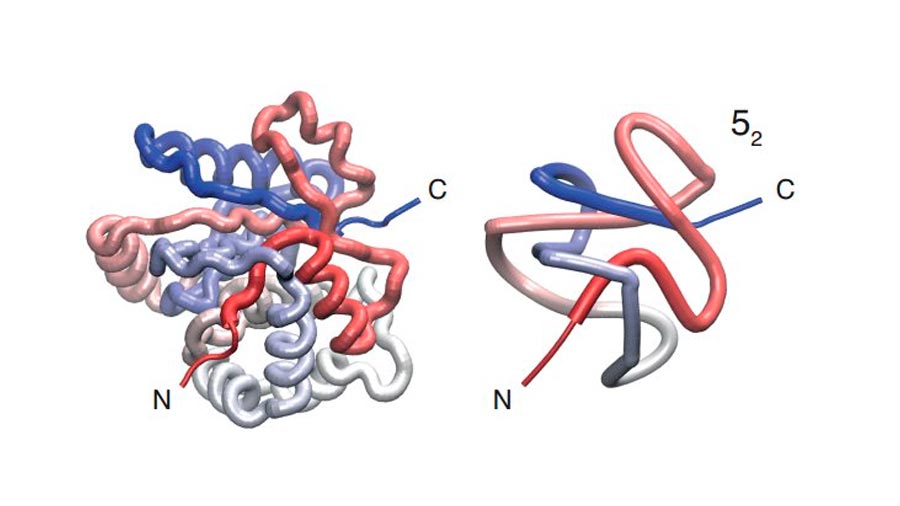
Los nudos se caracterizan en términos del número de puntos de cruce y el número de variaciones que permiten. Un sencillo nudo en forma de trébol tiene tres puntos de cruce con tan sólo una variación, por lo que es designado como 31. El nudo más complejo con cinco puntos de cruce tiene dos versiones designadas como 51 y 52, mientras que los nudos con siete puntos de cruce tienen siete variedades designadas como 71, 72 y así sucesivamente. El número de variaciones aumenta exponencialmente con el número de puntos de cruce.
Los biólogos han descubierto una creciente variedad de nudos en las proteínas. De hecho, alrededor del uno por ciento de las entradas del Banco de Datos de Proteínas tiene nudos, y al menos 19 proteínas forman sencillos nudos en forma de trébol de 31.
Algunas de estas proteínas anudadas juegan un importante papel en la bioquímica humana. Por ejemplo, la isoforma 1 de la hidrolasa del terminal C de la ubiquitina humana (UCH-L1), designada como 52, representa hasta el cinco por ciento de las proteínas solubles de las neuronas.
Hay bastantes estudios centrados en la UCH-L1, en gran parte porque una versión no anudada de esta molécula se asocia a la enfermedad de Parkinson. En un estudio, los investigadores emplearon pinzas ópticas para generar diferentes versiones de esta molécula que eran o no anudadas o designadas como 31 52. Entonces midieron cómo la proteína volvía a plegarse.
Resulta que la presencia de un nudo ralentiza significativamente la velocidad del plegamiento de una proteína. También crea un paisaje energético más complejo que permite un abanico mucho más amplio de formas intermediarias durante el plegamiento. Además, la región de nudos de 52 acaba siendo mucho más grande de lo que necesita ser.
Exactamente qué papel podrían jugar las formas adicionales o por qué una velocidad de plegamiento más lenta podría resultar importante no está claro. Todo esto tendrá que explorarse computacionalmente en el futuro. La complejidad de estos problemas aumenta la dificultad de esta tarea, incluso para los ordenadores más potentes. Así que conseguir mejores simulaciones de plegamiento serán una importante área de trabajos futuros.
Una pista interesante es que los nudos a menudo se producen en proteínas ubicadas cerca de donde las enzimas se adhieren a una molécula. Eso sugiere que la forma del nudo es crucial en el esquema de llave y candado. Esto podría explicar su presencia. Puede que los nudos permitan a una proteína formar estructuras que de otra manera resultan difíciles o imposibles de lograr.
El equipo de Jackson termina con una lista de preguntas sin respuesta. Algunas están relacionadas con limitaciones que los biólogos tienen para simular los nudos. Por ejemplo, ¿estas simulaciones obvian algún paso importante del proceso de formación de nudos?
Otro reto consiste en entender si a partir de nudos compuestos (uno dentro de otro) pueden formarse estructuras más complejas. Algunos trabajos teóricos sugieren que este tipo de estructuras podrían generar importantes beneficios.
Y por último, ¿es posible desanudar una proteína mediante unos pocos cortes precisos? Es algo que una emprendedora enzima podría lograr con facilidad.
Comprender mejor el papel que juegan los nudos en el plegamiento de proteínas tendrá importantes implicaciones para la bioquímica. Y este tipo de información también podría servir para descubrir y desarrollar fármacos terapéuticos. Por eso estas preguntas tienen algo más que un simple interés académico.
Fuente: technologyreview.es