Dannia Colín Castelán
Centro Médico Nacional Siglo XXI
Dannia Colin Castelán es Licenciada en Investigación Biomédica Básica y tiene el doctorado en Ciencias Biomédicas. Actualmente realiza un postdoctorado en la Unidad de Investigaciones Médicas en Enfermedades Oncológicas del Centro Médico Nacional Siglo XXI, estudiando las células tumorales que se desprenden de tumores causando metástasis, específicamente en cánceres de páncreas. Forma parte del Taller de Escritura Creativa en Ciencia y Portal Cienciorama de la DGDC (http://www.cienciorama.unam.mx/). La ACMOR agradece a Cienciorama que nos comparta este texto.
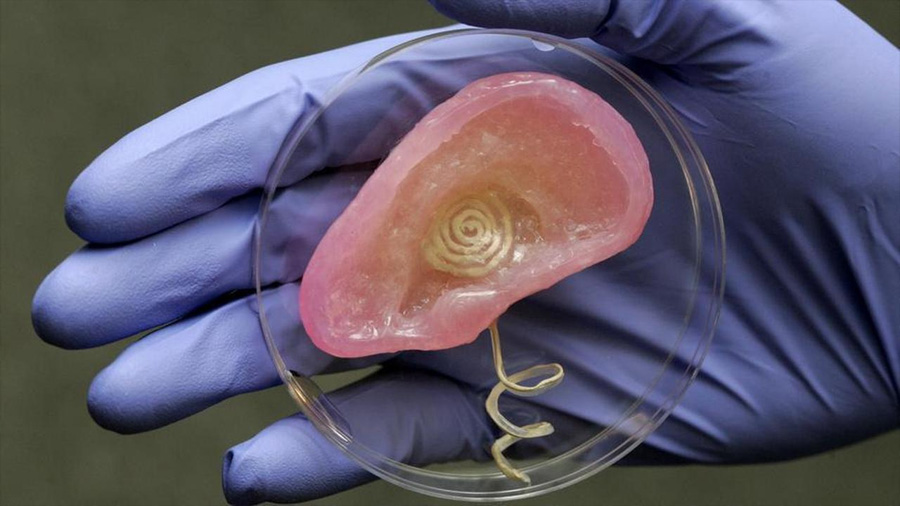
Cada año miles de personas mueren en espera de un trasplante de órganos. Por eso desde hace más de dos décadas hay investigadores en todo el mundo tratando de fabricar órganos humanos fuera del cuerpo y erradicar la necesidad de usar órganos de donadores cadavéricos. Se utilizan células embrionarias o células reprogramadas obtenidas del propio paciente para intentar construir un órgano nuevo. Y aunque la idea parezca sacada de la cabeza de Aldous Huxley, hay avances que nos están acercando a un mundo donde podremos reemplazar órganos sin donación. El camino ha sido largo, tortuoso y todavía nos falta mucho por andar pero veamos qué tan cerca estamos de tener órganos de repuesto.
Bio-ingenieros al rescate
“El cuerpo humano es una máquina perfecta.” ¿Quién no ha escuchado esta frase? Los distintos órganos y sistemas del cuerpo funcionan en conjunto para mantenernos vivos, activos, conscientes. Y aunque el símil se queda corto, muy corto, digamos que la máquina humana es como un auto, y a veces alguna de las partes deja de funcionar. Sin embargo, a diferencia de las autopartes, los órganos humanos no se consiguen en una refaccionaria. En la actualidad cuando una persona tiene una falla orgánica severa y requiere un trasplante, se ve en una situación increíblemente complicada, ya que los órganos disponibles para trasplantar son muy escasos. Sólo el riñón, el hígado, la médula ósea y la sangre se pueden obtener de un donante vivo… y sólo en algunos casos. El corazón, la piel, el páncreas, el intestino, las córneas, los huesos, los pulmones, la tráquea, la cara y las extremidades sólo se trasplantan a partir de cadáveres. Actualmente los órganos y tejidos sólo se pueden obtener por donación, lo que implica que generalmente los pacientes tengan que esperar a que una persona sana e inmunológicamente compatible muera en condiciones específicas dentro de un hospital y que la familia del fallecido autorice la donación de sus órganos. Es en este contexto que nace la ingeniería de tejidos.
La ingeniería de tejidos es una rama de la biomedicina en la que se toman células y sustancias que tienen la capacidad de integrarse a un organismo (biomateriales) para construir un órgano o tejido que se pueda trasplantar sin necesidad de esperar un donante. La idea es literalmente construir tejidos y órganos de repuesto (ver en Cienciorama “Fábrica de órganos”). Además, dado que en algunos casos la idea es usar células de los propios pacientes para desarrollar los órganos necesarios, se elimina la posibilidad de rechazo inmunológico. Imagina que los pacientes en vez de inscribirse en una lista de espera de recepción de órganos, puedan simplemente mandar a hacer un corazón o un páncreas como si fuera una prótesis. Sería fantástico ¿no te parece? ¿Y por qué aún no podemos hacemos eso? Bueno, a continuación vamos a revisar qué tan cerca o lejos estamos de fabricar órganos humanos de repuesto.
Lo bueno: corazón partido
Todavía no podemos ir a una refaccionaria a comprar un riñón cuando uno de los nuestros ya no funciona, pero hay avances importantes en la ingeniería de tejidos; esto es, la construcción de tejidos in vitro. Uno de los órganos en los que más se está trabajando es el corazón, específicamente en las válvulas cardiacas. Las válvulas cardiacas pueden deteriorarse por la edad, se calcifican o se degradan por alguna infección o pueden tener alguna malformación congénita. En todos estos casos es necesario reemplazarlas pero las prótesis existentes, ya sea bovinas o mecánicas, no se integran muy bien a los corazones receptores y tienen que ser reemplazadas varias veces a lo largo de la vida de los pacientes. Tratando de encontrar una mejor alternativa se está intentado fabricar válvulas cardiacas con un biomaterial y células pluripotenciales derivadas de los propios pacientes. La idea es tomar células de la piel de un paciente y reprogramarlas para convertirlas en células de válvula cardiaca. Una vez reprogramadas, las células son cultivadas en un material bio-compatible en forma de válvula que puede ser trasplantado. La ventaja de este enfoque es que tales válvulas serían 100% compatibles con el paciente y no tendrían que volver a reemplazarse. Sin embargo estas prótesis están aún en desarrollo. En México se están desarrollando algunos de estos andamios en el Instituto de Investigaciones en Materiales (Dr. Ricardo Vera Graziano).
Cuando el cartílago falla
El cartílago es un tejido elástico que se encuentra en todas las articulaciones, orejas, nariz y en los discos intervertebrales. A veces por el sobrepeso, la edad, un movimiento repetitivo o cargar cosas pesadas con una mala técnica, los cartílagos se desgastan o se hernian y deben ser reemplazados. Las alternativas comúnmente usadas para el reemplazo de cartílago son articulaciones protésicas de acero quirúrgico y polietileno o silicón que tienen una vida media de entre 10 y 15 años después de los cuales deben reemplazarse de nuevo. En muchos casos la convalecencia quirúrgica es complicada y los pacientes no recuperan toda su movilidad, así que algunos investigadores se lanzaron a la búsqueda de una alternativa… y la encontraron. La empresa alemana Tissue Engineering Technologies AG desarrolló una matriz tridimensional a base de colágeno en la que cultivan células de cartílago –condrocitos– obtenidas del propio paciente. Para cada caso imprimen en 3D la forma del cartílago que se va a reemplazar y lo cultivan con condrocitos obtenidos del paciente, unas semanas después envían la bio-prótesis al hospital donde se implantará. La cirugía es menos invasiva que la tradicional, no produce rechazo y la probabilidad de requerir una cirugía de revisión es menor. De hecho para algunos pacientes con lesiones relativamente leves, la cirugía se vuelve innecesaria ya que una de las tecnologías que desarrollaron es una mezcla inyectable que contiene células y una matriz líquida que se polimeriza una vez en la articulación. Esta tecnología aún se considera en fase experimental pero ya se está aplicando en pacientes como parte de las pruebas clínicas.
Hígado en construcción
A diferencia de las articulaciones, las válvulas cardiacas o el páncreas, no existen aún los hígados artificiales, así que los pacientes con insuficiencia hepática tienen que esperar una donación. El tiempo de espera para un trasplante de hígado en México es de por lo menos 30 meses y muchos pacientes nunca llegan a recibir el hígado que necesitan; por lo tanto, se están haciendo esfuerzos para construir hígados funcionales trasplantables in vitro. El grupo japonés del Dr. Hideki Taniguchi de la Universidad de Yokohama desarrolló un cultivo tridimensional de células hepáticas de fetos humanos y células vasculares de cordón umbilical humano. Estas estructuras al trasplantarse en ratones sobreviven a largo plazo, desarrollan vasos sanguíneos funcionales, maduran y producen las proteínas y enzimas que produce un hígado normal. A pesar de estos avances promisorios aún no se ha conseguido construir un hígado completo.
Piel de laboratorio
La piel se puede perder por varias razones, entre ellas están las quemaduras, infecciones, cirugías y úlceras crónicas, y también que no siempre vuelve a cicatrizar sola. Cuando la lesión alcanza la dermis –segunda capa de la piel– normalmente se usan injertos de piel cadavérica para proteger el área dañada. Sin embargo, en la mayoría de los casos estos injertos son rechazados, deben ser reemplazados y el proceso de curación es lento y doloroso. Cuando las lesiones son tan severas que no pueden regenerarse por sí solas se utiliza piel del propio paciente para injertarla en las zonas lesionadas, lo que deja las áreas donantes de piel desprotegidas y susceptibles a infecciones. Para resolver estos problemas biotecnólogos del CINVESTAV desarrollaron injertos de piel humana cultivada que aceleran la cicatrización en los pacientes. Lo que hicieron fue obtener una muestra de piel humana, después separaron las células de la capa exterior de la piel llamadas queratinocitos, y posteriormente los cultivaron en una matriz de proteínas. Esta forma de cultivo favorece que los queratinocitos crezcan formando una capa que imita fielmente la epidermis humana –capa externa de la piel–. Los cultivos se mantienen en un banco de piel de donde se obtienen parches de piel viva que al colocarse sobre las lesiones producen factores de crecimiento que inducen la regeneración de la piel del propio paciente sin rechazo. Esta tecnología está disponible comercialmente desde 1999.
Lo cuestionable
Las células adultas tienen un potencial de regeneración limitado por lo que la mayoría de los experimentos pre-clínicos de ingeniería de tejidos se hacen con células embrionarias. Actualmente existen tres posibles fuentes de células embrionarias humanas: la primera y la menos controvertida son líneas celulares embrionarias ya establecidas. Las líneas celulares son células que originalmente se sacaron de embriones humanos pero que llevan ya mucho tiempo siendo cultivadas como células separadas para distintos tipos de investigación; por ejemplo farmacología, cáncer y patrones de desarrollo embrionario. Las líneas celulares establecidas ya no pueden formar un humano; aunque pueden formar algunas células maduras, ya perdieron la capacidad de formar órganos y sistemas complejos por sí mismas por lo que hay poco conflicto ético en utilizarlas. La segunda fuente de tejido embrionario son embriones obtenidos por clonación por transferencia nuclear. El mismo proceso por el que se generó la oveja Dolly en 1996. Lo que se hace es que se toma un óvulo sano y se le intercambia el núcleo por aquel de una célula adulta de cualquier individuo que se desee clonar. Después se le aplica una pequeña corriente eléctrica y así se inicia la formación del embrión. Los embriones generados de esta forma son clones exactos del individuo que donó la célula adulta y podrían llegar a formar un organismo completo si se los implantara en un útero.
La tercera y última fuente de células embrionarias son los embriones descartados de las clínicas de fertilidad. Cuando una pareja tiene problemas de fertilidad y recurre a la fertilización in vitro generalmente se producen varios embriones y en cada ronda de implantación se colocan sólo unos pocos con la esperanza de que alguno llegue a término. Frecuentemente la pareja consigue embarazarse antes de usar todos los embriones producidos y esos embriones normalmente se descartan o se donan para investigación. En el proceso de extracción de células de embriones clonados o donados se destruyen los embriones, pero hay fuertes implicaciones éticas que excluyen el tejido embrionario humano como una fuente tisular para uso clínico generalizado.
Por otro lado se está intentando usar células pluripotenciales inducidas paciente-específicas para construir los tejidos a regenerar (ver en Cienciorama “El curioso caso de la reprogramación celular Premio Nobel de Medicina 2012”). Esto implica tomar células del paciente, reprogramarlas al tipo celular necesario, expandirlas, cultivarlas en un material biocompatible y trasplantarlas de vuelta al paciente (ver figura 1). La gran ventaja aquí es que los pacientes no rechazarían los trasplantes. La desventaja es que la reprogramación y expansión de células de un paciente es un proceso lento y con frecuencia, poco eficiente. A veces puede tomar hasta seis meses obtener células trasplantables, tiempo que no todos los pacientes tienen. Además, los protocolos de reprogramación celular existentes no siempre son específicos. A veces se necesita producir un tipo específico de célula pero los protocolos existentes producen varios subtipos celulares mezclados. Por ejemplo para tratar la epilepsia se necesita generar neuronas GABAérgicas pero en el cultivo se obtienen distintas neuronas, GABAérgicas, dopaminérgicas y glutamatérgicas. Estas mezclas no siempre se pueden usar porque aunque se haya producido un gran número de células, frecuentemente se obtiene poca cantidad del subtipo celular requerido para la terapia.
Otra limitante para el desarrollo de órganos artificiales es que los órganos son estructuras complejas que contienen muchos tejidos diferentes con una organización tridimensional específica. Que el tejido conectivo esté junto al tejido muscular y el muscular junto al vascular es crucial para el funcionamiento de un corazón (figura 2). Si la estructura tridimensional se altera, el corazón no funciona. Estas estructuras tan complejas son muy difíciles de replicar en un laboratorio. En cualquier caso se está trabajando para superar todas estas limitantes y como ya vimos anteriormente sí se está avanzando. Tanto así que ya hay tecnología que se está usando con éxito en humanos.
Lo antiético
Desde el año 2010 Paolo Macchiarini, cirujano renombrado del Instituto Karolisnka, desarrolló tráqueas artificiales utilizando un biopolímero y células troncales extraídas de la médula ósea de pacientes con diversas afecciones respiratorias. Posteriormente trasplantó las tráqueas artificiales a estos pacientes en una cirugía experimental. A continuación reportó que los procedimientos habían sido un gran éxito, pero seis de los ocho pacientes que recibieron sus trasplantes murieron y los dos sobrevivientes han sido sometidos a cirugías donde se les retiraron los implantes experimentales. Una de las personas que se sometió a la cirugía experimental y falleció fue una joven rusa que tenía una condición respiratoria no fatal, por lo que actualmente Macchiarini, quien perdió su empleo a principios del 2016, está siendo investigado en Suecia por homicidio culposo. Aparentemente Macchiarini decidió no hacer ensayos pre-clínicos en animales para estudiar la seguridad del procedimiento y “exageró” sus resultados.
Este caso es probablemente el más sonado en torno a la mala praxis en la ingeniería de tejidos pero no es el único. De hecho en México existen varias clínicas que dicen usar células madre para el tratamiento de enfermedades degenerativas o “revertir el envejecimiento”. Como hemos visto la ingeniería de tejidos es un campo en crecimiento pero hay pocos procedimientos probados y aprobados para su uso en humanos. La mayoría de estas clínicas, en el mejor de los casos, sólo buscan sacar provecho de la necesidad de los pacientes sin ayudarles en lo más mínimo. En el peor de los casos podrían estar poniendo en peligro la integridad física de las personas.
La ingeniería de tejidos nos aguarda muchas promesas y sorpresas. Los órganos sintéticos aún son parte de la ciencia ficción pero aparentemente no lo serán por mucho más tiempo. De cualquier modo debemos hacer toda la ciencia necesaria para asegurarnos de que los avances sean confiables y seguros.
Bibliografía
- Xu, W. et al. Application of a partial-thickness human ex vivo skin culture model in cutaneous wound healing study. Laboratory investigation; a journal of technical methods and pathology92, 584-599, doi:10.1038/labinvest.2011.184 (2012).
- Vander Roest, M. J. & Merryman, W. D. A developmental approach to induced pluripotent stem cells-based tissue engineered heart valves. Future Cardiol13, 1-4, doi:10.2217/fca-2016-0071 (2017).
- Tschugg, A., Michnacs, F., Strowitzki, M., Meisel, H. J. & Thome, C. A prospective multicenter phase I/II clinical trial to evaluate safety and efficacy of NOVOCART Disc plus autologous disc chondrocyte transplantation in the treatment of nucleotomized and degenerative lumbar disc to avoid secondary disease: study protocol for a randomized controlled trial. Trials17, 108, doi:10.1186/s13063-016-1239-y (2016).
- http://www.tetec-ag.com/cps/rde/xchg/cw-tetec-en-int/hs.xsl/7232.html> (2016).
- trasplantes, C. n. d. Estadísticas de trasplantes en México 2016, <http://www.cenatra.salud.gob.mx/interior/trasplante_estadisticas.html> (2016).
- Takebe, T. et al. Engineering of human hepatic tissue with functional vascular networks. Organogenesis10, 260-267, doi:10.4161/org.27590 (2014).
- León Neumann, A. G. P. r. U. El uso del aloinjerto epidérmico en cirugía oncológica cutánea. Dermatología Rev Mex55, 7 (2011).
- Romero, F. V. El árbol de la vida desde una perspectiva científica, <http://www.cienciorama.unam.mx/ – !titulo/285/?el-arbol-de-la-vida-desde-una-perspectiva-cientifica> (2013).
- Ávila, I. E. El curioso caso de la reprogramación celular Premio Nobel de Medicina 2012, <http://www.cienciorama.unam.mx/ – !titulo/331/?el-curioso-caso-de-la-reprogramacion-celular-premio-nobel-de-medicina> (2014).
- Macchiarini scandal is a valuable lesson for the Karolinska Institute, <http://www.nature.com/news/macchiarini-scandal-is-a-valuable-lesson-for-the-karolinska-institute-1.20539> (2016).
Fuente: Academia de Ciencias de Morelos