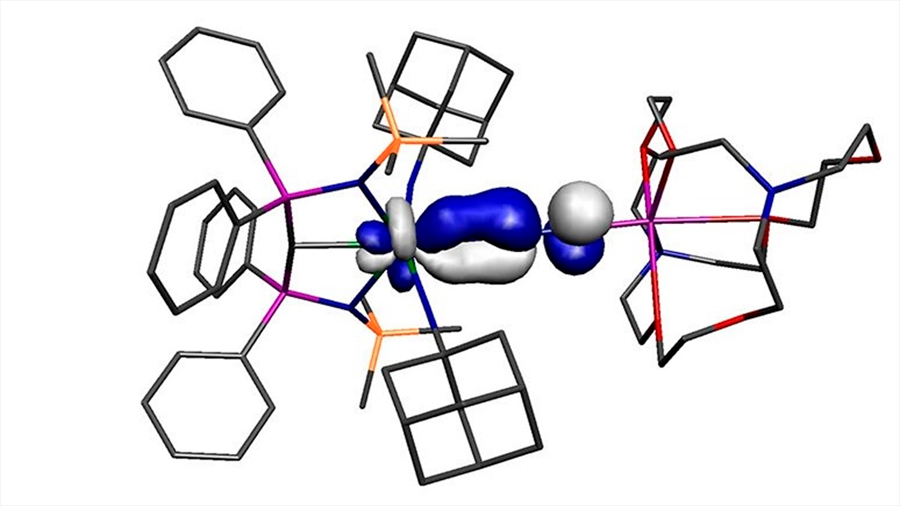
Una molécula de uranio dinitrógeno que, según la teoría química básica, no debería existir, ha sido reportada por científicos de la Universidad de Manchester.
La molécula que rompe las reglas, descrita en Nature Chemistry, podría tener implicaciones para la activación del dinitrógeno, que es una molécula esencial para producir fertilizantes.
Aproximadamente 450 millones de toneladas de fertilizante se producen cada año utilizando amoníaco hecho del proceso Haber Bosch, y este es un fertilizante que sustenta la vida en la Tierra. En Haber Bosch, el dinitrógeno se une a los metales en la superficie del catalizador y se divide. Luego reacciona con dihidrógeno para formar el amoníaco.
Dada la gran escala en la que opera Haber Bosh, durante muchos años ha habido interés en cómo el dinitrógeno se une a los metales de alrededor de la Tabla Periódica en complejos moleculares, ya que estas especies se pueden estudiar en detalle atómico, porque esto nos informa sobre la unión clave y dividiendo pasos en Haber Bosch. Esto explica la mayoría de las demandas de energía de este proceso.
Uno de los secretos mejor guardados de Haber Bosch es que, aunque el hierro es el catalizador elegido, el uranio es de hecho un catalizador superior, por lo que hay interés en cómo se une el uranio al dinitrógeno.
El dinitrógeno es aparentemente una de las peores moléculas para unirse a los metales. De hecho, es tan inerte que generalmente se usa como una atmósfera protectora para las síntesis químicas, y en el envasado de alimentos para evitar que los alimentos se salgan. Sin embargo, bajo ciertas circunstancias, se puede alentar la unión del dinitrógeno a los metales, y en este modelo el metal necesita estar en un estado de baja oxidación y ser lo suficientemente rico en electrones para participar en la unión, por lo que el dinitrógeno dona densidad de electrones al metal y el metal corresponde.
De ello se deduce que un estado de oxidación elevado y un metal pobre en electrones no debería poder participar en este modelo de unión porque no debería ser capaz de participar en la parte recíproca de la unión.
La molécula reportada en el estudio es un metal de alto estado de oxidación, pobre en electrones, pero se une al dinitrógeno, uno de los peores ligandos posibles. Por lo tanto, la molécula no debería existir, pero sí existe. La hipótesis de trabajo de por qué la molécula puede formarse es que el uranio está unido a tres ligandos donantes extremadamente fuertes, y a pesar de su alto estado de oxidación, estos tres ligandos hacen que el uranio sea inusualmente rico en electrones en general, y esto anula las restricciones habituales sobre la unión modelo.
Este trabajo reescribe una regla fundamental de la química, y puede tener implicaciones más amplias, porque mucha de la química de activación de dinitrógeno se basa en el supuesto de que se necesitan metales con un estado de oxidación bajo. Sin embargo, este estudio ahora muestra que los metales con alto estado de oxidación, en las circunstancias correctas, también podrían respaldar la nueva química de activación de dinitrógeno.
Este conocimiento permitirá a los científicos pensar de manera diferente sobre cómo abordar los desafíos de la activación de dinitrógeno e incluso podría influir en los estudios del proceso de Haber Bosch.
Fuente: europapress.es