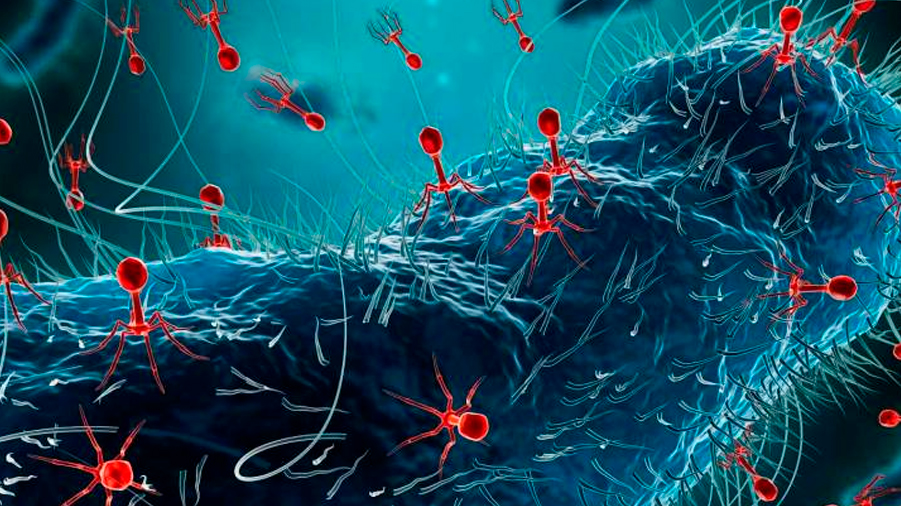
Las bacterias resistentes a los antibióticos están aumentando en todo el mundo y cada vez es más complicado hallar nuevos fármacos, por lo que enfermedades como la tuberculosis o la neumonía son difíciles (a veces imposibles) de tratar. La ciencia busca alternativas y una de las más prometedoras es la terapia fágica.
Aún en fase experimental, pero con casos de éxito en diversos hospitales del mundo, como el de una mujer con una infección por “Klebsiella pneumoniae”, víctima del atentado de 2016 en el aeropuerto de Bruselas, este tratamiento utiliza unos virus llamados bacteriófagos o fagos, que infectan exclusivamente a bacterias.
Se ha demostrado que son capaces de combatir las infecciones bacterianas más complejas, sobre todo cuando se combinan con antibióticos, resumen a EFE los investigadores Iñaki Comas (del Instituto de Biomedicina de Valencia) y Pilar Domingo-Calap (Instituto de Biología Integrativa de Sistemas (I2SysBio, CSIC-Universitat de València).
El problema de un uso excesivo de los antibióticos
Los antibióticos representan uno de los descubrimientos más revolucionarios. Sentaron los cimientos de la medicina moderna, permitiendo no solo curar infecciones antes letales, sino realizar intervenciones transformadoras como trasplantes, menciona el Consejo Superior de Investigaciones Científicas (CSIC) en un monográfico de su colección “Ciencia para las Políticas Públicas”.
Por desgracia, agrega, su uso excesivo ha causado un aumento espectacular de resistencia en las bacterias -que mutan-.
Esta es hoy una de las mayores amenazas para la salud mundial, la seguridad alimentaria y el desarrollo, y su aumento está adquiriendo niveles peligrosos, indica la Organización Mundial de la Salud.
Según un estudio de The Lancet, que analizó 204 países, cada año fallecen 1,2 millones de personas por infecciones resistentes a antibióticos y este número podría multiplicarse por diez en 2050. Se necesitan acciones urgentes.
“Cada vez es más difícil encontrar un antibiótico que sea realmente nuevo, por eso hay que buscar alternativas, y una de las más interesantes es la terapia con fagos”, declara Iñaki Comas, del Instituto de Biomedicina de Valencia (IBV) y coordinador de la Plataforma Salud Global del CSIC.
Los fagos, más de un siglo de historia
Los bacteriófagos se descubrieron hace algo más de un siglo por el microbiólogo franco-canadiense Félix d’Herelle, quien en 1919 usó por primera vez la terapia con pacientes.
Sin embargo, el hallazgo de la penicilina en 1928 y su posterior comercialización y boom de los antibióticos desbancaron la investigación de la fagoterapia, menos en algunos países de la antigua Unión Soviética, como Georgia, que aunque con altibajos en su trayectoria hoy es referente a través de su Instituto George Eliava, en Tiflis (Eliava trabajó con d’Herelle y fue ejecutado en 1937).
Pero con los años, y en gran medida por el mal uso (años de antibióticos sin receta médica y abuso en agronomía) empezaron a surgir resistencias, provocando estancias hospitalarias más largas y aumentando la mortalidad y los costos; por ejemplo, un caso normal de tuberculosis cuesta tratarlo en Europa unos 200 euros, pero 30.000 euros si la bacteria “Mycobacterium tuberculosis” es multirresistente.
Y en casos límites, cuando es extremadamente resistente, los costos pueden aumentar hasta los 200.000 euros, recuerda Comas.
Precisamente esta multi y superresistencia, para las que no funcionan los antimicrobianos en el mercado, son las que preocupan y han hecho que el foco científico vuelva a los fagos.
La dinámica de los fagos
Los bacteriófagos son virus que infectan y matan bacterias, son virus muy abundantes en la naturaleza y muy específicos, explica Pilar Domingo-Calap, del Instituto de Biología Integrativa de Sistemas (I2SysBio, CSIC-Universitat de València).
Reconocen una bacteria concreta y la utilizan; usan la maquinaria celular de esta para crear nuevos virus y entran en una especie de “carrera armamentística” contra la bacteria hasta lograr erradicarla.
Eliminan por tanto solo a las bacterias patógenas causantes de la enfermedad, una habilidad que convierte a esta terapia en una buena candidata para la medicina personalizada, de precisión.
Pero esta especificidad también puede ser una desventaja porque hay que buscar una mezcla adecuada de fagos para cada tipo de infección y al ser un virus, a diferencia de un medicamento con estructura química, su farmacodinámica es casi imposible de predecir y medir.
En cada paciente el resultado es diferente, por eso hay que cambiar la forma en la que hacer ensayos clínicos y cómo entender los resultados. “Vamos hacia una medicina muy personalizada”, agrega Domingo-Calap, quien participó, junto a Comas, en las jornadas Cicerón del CSIC para hablar de sus investigaciones frente a las superbacterias.
Comienzan a producirse en España
Falta, además, una regulación adecuada, aunque ya se trabaja en ello a nivel europeo. Ahora solo se pueden usar fagos como terapia compasiva y existen numerosos casos de éxito, algunos también en hospitales españoles (con fagos importados de Estados Unidos y Bélgica).
Estos ya se empiezan a producir en España; el laboratorio de Domingo-Calap ha conseguido aislarlos, caracterizarlos y desarrollarlos como herramientas terapéuticas.
De hecho, esta investigadora creó en abril Evolving Therapeutics SL, una “spin-off” ubicada en el parque científico de la Universitat de València para producir soluciones biotecnológicas basadas en estos virus, que ya se han probado -en una fase inicial- en unos pocos pacientes.
Uno de los casos más conocidos del tratamiento con estos virus, publicado en Nature Communications, es el de una mujer de 30 años víctima del atentado de 2016 en el aeropuerto de Bruselas, con una infección bacteriana relacionada con una fractura, para la que el tratamiento con antibióticos había fracasado durante casi dos años.
Después de las intervenciones en quirófano y su estabilización, la víctima evolucionó hacia un shock séptico debido una infección en la herida quirúrgica en el muslo izquierdo, a pesar del tratamiento antibiótico. El equipo del Hospital Erasme de Bruselas seleccionó entonces y adaptó un bacteriófago específico para la cepa de “K. pneumoniae”, terapia que combinó con antibióticos.
Esto dio como resultado una mejora clínica y microbiológica de las heridas, y de su estado general.
Fuente: efe.com