Un trabajo realizado por científicos de España y EE UU ha desvelado cómo funcionan un tipo de proteínas celulares: las chaperonas, en concreto las Hsp70. Como si fueran máquinas nanométricas, las Hsp70 generan fuerza sobre otras proteínas, como la clatrina, a través de colisiones y estiramientos para romper uniones entre ellas o transportarlas a través de las membranas de distintos compartimentos celulares.
Las chaperonas Hsp70 son proteínas implicadas en gran cantidad de procesos celulares: controlan la calidad de otras proteínas, las modifican y las transportan a través de membranas. Hasta ahora se habían planteado tres posibles mecanismos de funcionamiento de estas nanomáquinas moleculares (uno pasivo, otro activo, y uno intermedio denominado de ‘tirón entrópico’), pero no se conocía cuál era el modelo correcto.
Un trabajo publicado ahora en la revista Nature Structural and Molecular Biology ha puesto de manifiesto que las chaperonas Hsp70 consiguen completar su función a través de colisiones y estiramientos. Estas observaciones se ajustan al mecanismo propuesto por el modelo de ‘tirón entrópico’.
El estudio ha sido realizado por científicos del Centro Nacional de Biotecnología (CNB-CSIC) en colaboración con el Centro de Ciencias de la Salud en la Universidad de Texas (San Antonio, EE UU) y el Instituto Nacional de Imagen Biomédica y Bioingeniería (Bethesda, EE UU).
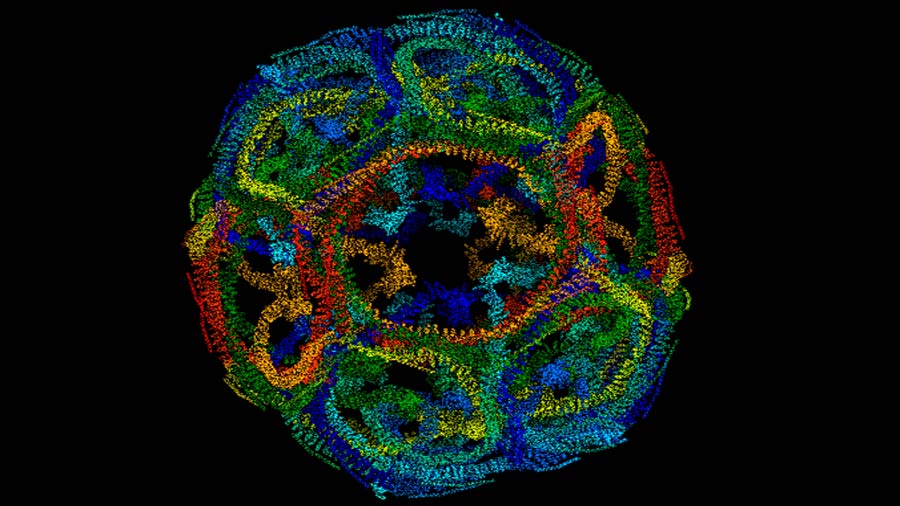
El estudio desvela por primera vez el mecanismo utilizado por Hsp70 para desmontar las cestas de clatrina, una proteína que reviste las vesículas encargadas de introducir material en el interior de la célula.
El secreto de la fuerza de Hsp70
“Las moléculas de Hsp70 se unen a la pared de clatrina a través de uno de los extremos de esta proteína –explican José María Valpuesta y Jorge Cuéllar, dos de los los autores del trabajo e investigadores del CNB-CSIC–. De esta manera tiene libertad para moverse haciendo presión sobre la pared hasta que las moléculas de clatrina se desencajan y la cesta se desmonta”.
Este efecto sobre las cestas de clatrina es todavía más eficiente debido a la propiedad especial de esta chaperona de autoasociarse y formar oligómeros que producen todavía una mayor presión sobre las paredes de las cestas. “A través de este mecanismo, se ejerce la fuerza necesaria para desensamblar las cestas”, explican los investigadores.
Los autores en el estudio aseguran que este mecanismo se puede generalizar a otras funciones de Hsp70 como el transporte de proteínas a través de la membrana de las mitocondrias, los lisosomas o el retículo endoplasmático.
Fuente: SINC