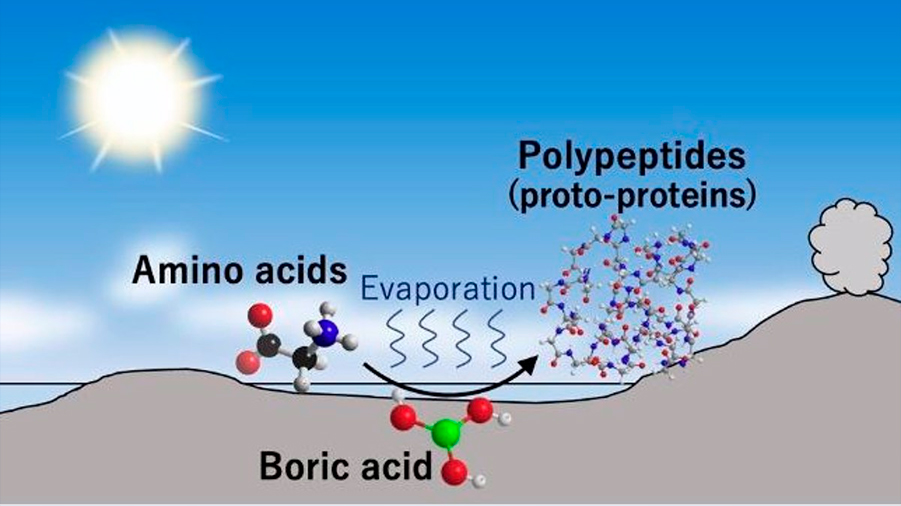
Científicos de la Universidad de Tohoku han descrito un entorno potencial para la reacción que creó los polímeros orgánicos catalíticos -proteínas primordiales- en la Tierra anterior a la vida.
Para ello, secaron soluciones de aminoácidos que contenían ácido bórico y descubrieron que el ácido bórico cataliza la síntesis de polipéptidos en condiciones neutras y ácidas. Los péptidos más largos formados en los experimentos fueron polipéptidos de glicina de 39 monómeros de longitud en condiciones neutras.
Los detalles de su investigación se publicaron en la revista Communications Chemistry.
Estudios previos han sugerido que los ambientes evaporativos altamente alcalinos sirvieron como lugar para la síntesis de proteínas antiguas, produciendo hasta 20 péptidos de glicina de monómero de longitud. Se pensaba que las condiciones neutras eran el peor de los casos en lo que respecta a la síntesis de péptidos.
Se han descubierto abundantemente minerales que contienen boro en algunas de las rocas de origen sedimentario más antiguas encontradas en la Tierra, que datan de hace 3.800 millones de años. Estos hallazgos sugieren que las áreas costeras de los antiguos pequeños continentes e islas ricas en ácido bórico ensamblaron espontáneamente aminoácidos, formando polipéptidos y protoproteínas.
«La formación de polipéptidos en ambientes neutrales tiene significados importantes en la evolución química del origen de la vida», dice el autor principal Yoshihiro Furukawa, profesor asociado de la Universidad de Tohoku.
Mientras que los ARN son bastante estables en condiciones neutras, son extremadamente inestables en condiciones alcalinas. Se sabe que el boro ayuda en muchos pasos de la síntesis de ribonucleótidos abióticos.
«Los ambientes evaporativos neutrales ricos en boro sirven como un lugar ideal para las formaciones e interacciones entre los dos polímeros esenciales en la Tierra prebiótica», dice Furukawa.
Este grupo de investigación ahora está investigando qué aminoácidos se incorporan en los protopéptidos en este entorno.
Fuente: europapress.es